Окислительно-восстановительные гальванические элементы содержат окислительно-восстановительные электроды. К последним относятся все электроды, в реакциях на которых не участвуют ни металлы, ни газы, а только ионы и нейтральные молекулы. При реакциях на электродах в этом случае не происходит ни растворения, ни выделения каких − либо веществ из растворов электролитов, а электроды в данном случае служат только переносчиками электронов. Окислительно-восстановительные электроды представляют собой чаще всего платиновую или изготовленную из другого инертного материала пластинку, погруженную в раствор, содержащий одновременно и окисленную, и восстановленную форму одного и того же иона (например: Fe 3+ и Fe2+; Сг2О72- и Cr3+; MnO4- и Mn2+ и т.д.). Окислительно-восстановительные электрохимические реакции в данном случае связаны с изменением степени окисления элементов, входящих в состав ионов.
В практике электрохимических измерений потенциалы окислительно-восстановительных электродов, как и электродов других типов, определяются по отношению к электроду сравнения. Обычно это стандартные хлорсеребряный или каломельный электроды, относящиеся к электродам второго рода.
Процессы, протекающие при работе окислительно-восстановительных элементов, рассмотрим на конкретном примере.
Электролитом первого электрода будет служить смесь растворов солей Fe2(SO4)3 и FeSO4, которая содержит ионы железа в различной степени окисления Fe3+ и Fe2+ , а второго − смесь растворов MnSO4 и KMnO4, содержащая ионы Mn2+ и MnO4-, в которых степень окисления марганца равна соответственно +2 и +7.
Схематически эти окислительно-восстановительные электроды изображаются следующим образом:
Pt│Fe3+, Fe2+ и Pt│Mn2+, MnO4-
При погружении инертного электрода (Pt) в раствор, содержащий смесь двух солей FeSO4 и Fe2(SO4)3, на границе раздела фаз возникает окислительно-восстановительный потенциал, иначе называемый редокс (Red/Ox) потенциалом, за счет окислительно-восстановительной реакции между двумя ионами Fe2+ и Fe3+ в растворе
Fe2+ - е ↔ Fe3+.
Уравнение Нернста для такого Red/Ox потенциала запишется следующим образом:

или при Т = 298 К
 , (3.13)
, (3.13)
где  = 0,77 В − стандартный окислительно-восстановительный потенциал при [Fe3+] = [Fe2+] = 1 г-ион/л;
= 0,77 В − стандартный окислительно-восстановительный потенциал при [Fe3+] = [Fe2+] = 1 г-ион/л;
На втором электроде протекает окислительно-восстановительный процесс MnO4- + 8H+ + 5 e ↔ Mn2+ + 4H2O, потенциал которого
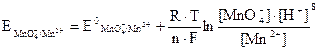
или для Т = 298 К
 . (3.14)
. (3.14)
Схема рассмотренного гальванического элемента может быть записана следующим образом:
(-)Pt|Fe3+,Fe2+|| MnO4-,Mn2+,H+|Pt(+), (3.15)
а протекающая в нем суммарная токообразующая реакция запишется так:
● в ионной форме:
5Fe2+ + MnO4- + 8H+ +5 e →5Fe3+ + Mn 2+ + 4H2O;
(3.16)
● в молекулярной форме:
10FeSO4 + 2 KMnO4 + 8H2SO4 →5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O (3.17)
Для определения стандартной ЭДС гальванического элемента, как уже было сказано выше, следует от потенциала катода с более положительным потенциалом (окислителя) вычесть потенциал анода (восстановителя) с менее положительным значением потенциала:
∆ E0 =  = 1,51-0,77 = 0,74 В (3.18)
= 1,51-0,77 = 0,74 В (3.18)
Процессы окисления-восстановления на электродах будут происходить до тех пор, пока их потенциалы не станут равными и в системе не установится состояние равновесия.