Строение молекул аренов.
Все 6 атомов углерода находятся в sp2 -гибридизации. Каждый атом углерода образует 2 σ -связи с двумя соседними атомами углерода и одним атомом водорода, которые находятся в одной плоскости. Углы составляют 120°. Т.е. все атомы углерода лежат в одной плоскости и образуют шестигранник. У каждого атома есть негибридная р -обиталь, на которой находится неспаренный электрон. Эта орбиталь перпендикулярна плоскости, и поэтому π -электронное облако «размазано» по всем атомам углерода:

Все связи равноценны. Энергия сопряжения – количество энергии, которую надо затратить, чтобы разрушить ароматическую систему.
Именно это обуславливает специфические свойства бензола – проявление ароматичности. Это явление было открыто Хюккелем, и называется правилом Хюккеля.
2. Изомерия аренов.
Арены можно разделить на 2 группы:
· производные бензола:

· конденсированные арены:

Общая формула аренов – СnH2n-6.
Для аренов характерна структурная изомерия, которая объясняется взаимным расположением заместителей в кольце. Если в кольце находится 2 заместителя, то они могут находиться в 3-х различных положениях – орто (о-), мета (м-), пара (п-):

Если от бензола «отобрать» один протон, то образуется радикал − C6H 5, которое носит название арильного радикала. Простейшие:

Называют арены словом «бензол» с указанием заместителей в кольце и их положения:

Свойства аренов.
Физические свойства аренов.
Первые члены ряда – жидкости без цвета с характерным запахом. Они хорошо растворяются в органических растворителях, но нерастворимы в воде. Бензол токсичен, но имеет приятный запах. Вызывает головную боль и головокружения, при вдыхании больших количеств паров можно потерять сознание. Раздражает слизистую оболочку и глаза.
|
|
Химические свойства аренов.
Реакции замещения аренов.
Ядро аренов обладает подвижной π -системой, на которую действуют электрофильные реагенты. Для аренов характерно электрофильное замещение, которое можно представить так:

Электрофильная частица притягивается к π -системе кольца, затем образуется прочная связь между реагентом Х и одним из атомов углерода, при этом единство кольца нарушается. Для восстановления ароматичности выбрасывается протон, а 2 электрона С−Н переходят в π-систему кольца.
1. Галогенирование происходит в присутствии катализаторов – безводных хлоридов и бромидов алюминия, железа:

2. Нитрование аренов. Бензол очень медленно реагирует с концентрированной азотной кислотой при сильном нагревании. Но если добавить серную кислоту, то реакция протекает очень легко:
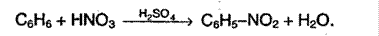
3. Сульфирование протекает под воздействием 100% - серной кислоты – олеума:

4. Алкилирование алкенами. В результате происходит удлинение цепи, реакция протекает в присутствии катализатора – хлорида алюминия:
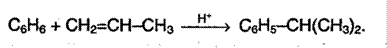
Реакции присоединения аренов.
1. Гидрирование (при катализаторах) аренов:


2. Радикальное галогенирование при взаимодействии паров бензола и сильного УФ-излучения. В результате образуется твердый продукт – С6H6Cl6:
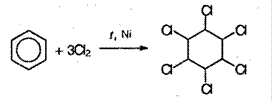
3. Окисление кислородом воздуха. Реакция протекает при оксиде ванадия (V) и 400°С:

Гомологи бензола имеют ряд отличий – на их продукты я изначальный заместитель в кольце:
|
|
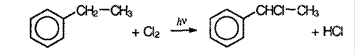
Замещение в кольце возможно только в присутствие катализатора (хлорида железа и алюминия), замещение протекает в орто- и пара- положения по отношению к алкильному радикалу:

Если действуют сильные окислители (перманганат калия), то цепь алкильная разрушается и образуется бензойная кислота:


4. Способы получение аренов.
1. Из алифатических углеводородов с помощью «ароматизации» предельных углеводородов, входящих в состав нефти. При пропускании над платиной или оксидом хрома наблюдается дигидроциклизация:
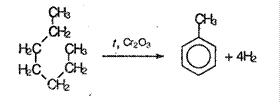
2. Дегидрирование циклоалканов:
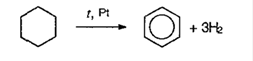
3. Из ацетилена (тримеризация) при пропускании над раскаленным углем при 600°С:
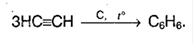
4. Реакция Фриделя – Крафтса в присутствии хлорида алюминия:

5. Сплавление солей ароматических кислот с щелочью:

Вопросы: (для контроля знаний)
- Какие вещества относятся к аренам?
- Какие виды изомерии характерны для аренов? Приведите примеры.
- Какие химические реакции характерны для аренов? Приведите уравнения реакций.
- При помощи каких реакций можно получить арены?
Список используемых источников:
- О.С. Габриелян и др. Химия. 10 класс. Профильный уровень: учебник для общеобразовательных учрждений; Дрофа, Москва, 2005г.;
- «Репетитор по химии» под редакцией А. С. Егорова; «Феникс», Ростов-на-Дону, 2006г;
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 10 кл. М., Просвещение, 2001;
- https://www.calc.ru/Areny-Svoystva-Arenov.html