Применение метода дипольных моментов в химии охватывает широкий круг проблем: установление конфигурации молекул, конформационного и изомерного состава вещества, распределения электронной плотности в молекуле в зависимости от структуры и электронного влияния заместителей в молекуле и т. д. В общем случае структурная интерпретация дипольного момента основана на сравнении экспериментальных величин с расчетными значениями, полученными квантово-химическим расчетом, а чаще всего при помощи приведенной выше аддитивной векторной схемы. При этом считается, что все высокосимметричные молекулы не должны иметь дипольного момента, т. к. дипольные моменты отдельных связей и групп в них взаимно компенсируются, как, например, в соединениях V - VII:
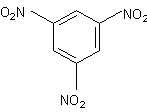


μ = 0 μ = 0 μ = 0.
V VI VII
С этих позиций очень легко отличать друг от друга цис- (VIII) и транс- (IX) изомеры:


цис-изомер; μ = 2.42 D транс-изомер; μ = 0
VIII IX
Для цис-изомеров полярные группы лежат по одну сторону от оси симметрии, и их дипольные моменты взаимно не компенсируются, а для транс-изомеров они расположены симметрично относительно оси симметрии, и дипольные моменты связей взаимно компенсируются. Эти представления сыграли большую роль в установлении структуры платиновых и палладиевых комплексов с S-, Se-, P-, As- и Sb-содержащими органическими лигандами. Были выделены комплексы двух форм, α и β, с различными физико-химическими свойствами. Как оказалось, комплексы β-форм имеют высокие дипольные моменты и находятся в цис-форме, в то время как их изомеры в α-формах имеют меньший или нулевой дипольный момент и находятся в транс-форме/
Для транс-формы совершенно необязательно равенство нулю дипольного момента, т. к. даже для симметричной молекулы различные части ее могут выходить из плоскости симметрии, и их вклад в суммарный дипольный момент может не компенсироваться. Так, например, сопоставление дипольных моментов цис-транс-изомеров X и XI:


цис-; μ = 7.38 D. транс-; μ = 0.50 D.
X XI
ясно указывает на транс-строение соединения XI, а небольшое значение m свидетельствует о выходе нитрогруппы из плоскости симметрии. Дипольный момент транс-формы не всегда имеет малое значение, т. к. бывают группировки и фрагменты молекул высокой полярности, и их незначительное отклонение от плоскости симметрии дает ощутимое значение дипольного момента, хотя в целом молекула имеет симметричное транс-строение. Так, например, транс-изомеры комплексов платины могут иметь значение дипольного момента до 2¸3 D (табл. 3). В этих случаях нужно сопоставлять дипольные моменты цис-транс-изомеров в систематических рядах, а также строить обоснованные стереохимические модели, позволяющие объяснить эти различия; в частности, высокий дипольный момент 2.75 D комплекса платины с нитрогруппой объясняется выходом одной связи N-O из плоскости, в которой находится молекула в целом. Другой пример: цис-транс-изомеры XII - XIII:


цис-; μ = 4.52 D. транс-; μ = 3.11 D.
XII XIII
где в соединении XIII выход из плоскости молекулы полярных фрагментов молекулы (фенилнитрогруппы) приводит к значительному дипольному моменту транс-формы. При отсутствии полярных заместителей цис-транс-изомерия проявляется методом дипольных моментов более однозначно, как, например, цис- и транс-изомеры азобензола XIV - XV:


цис-; μ = 3.00 D. транс-; μ = 0.
XIV XV
Дипольный момент – весьма чувствительная величина к структурным перестройкам молекулы, если эти перестройки связаны с изменением ориентации очень полярных группировок, поэтому он фиксирует даже цис-транс-изомеры относительно одинарной связи (s-цис-транс-изомеры), например, цис-транс-изомеры XVI - XVII:
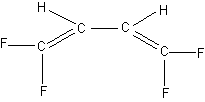

цис-; μвыч = 2.0 D. транс-; μ = 0.
XVI XVII
В более сложных случаях, когда существует смесь цис-транс-изомеров или возможно вращение вокруг одинарной связи, необходимо сопоставлять рассчитанные и экспериментальные значения дипольных моментов, позволяющие учесть по аддитивной схеме долю того или иного изомера в смеси. В таблице 4 приведены данные для ряда гетероциклических органических соединений:
Таблица 4. Дипольные моменты гетероциклических кетонов,
альдегидов и их анилов
| № п/п | Соединение | μвыч, D (s-цис) | μвыч, D (s-транс) | μоп, D |
| Фурфурол | 3.54 | 2.82 | 3.56 | |
| 5-Хлорфурфурол | 3.48 | 1.35 | 3.37 | |
| 5-Бромфурфурол | 3.43 | 1.74 | 3.37 | |
| 5-Иодфурфурол | 3.44 | 2.24 | 3.29 | |
| 5-Нитрофурфурол | 4.61 | 1.42 | 3.46 | |
| 2-Тиофенальдегид | 3.39 | 2.82 | 3.48 | |
| 2-Ацетилтиофен | 3.40 | 2.62 | 3.36 | |
| 2-Пирролальдегид | 1.94 | 3.84 | 1.88 | |
| 2-Ацетилпиррол | 1.21 | 4.13 | 1.52 | |
| 2-Пиридинальдегид | 5.05 | 3.51 | 3.35 | |
| 2-Ацетилпиридин | 5.15 | 2.95 | 2.84 | |
| 2-Пиридинальанилин | 3.67 | 1.14 | 1.43 |
Из этих данных видно, что все производные от пятичленных гетероциклов существуют в растворе в виде s-цис-конфигурации, а производные от шестичленного гетероцикла пиридина находятся преимущественно в s-транс-форме. Для 5-нитрофурфурола обе конфигурации примерно равновероятны.
В лекции кратко изложены основы метода дипольных моментов и приведены лишь немногочисленные примеры применения метода дипольных моментов для установления строения молекул. Объем и уровень лекции не позволяют коснуться других интересных и важных проблем, решаемых методом дипольных моментов: изучения конформаций молекул, внутреннего вращения отдельных групп, исследования методом дипольных моментов внутримолекулярных индукционных и мезомерных эффектов, таутомерии, водородных связей, межмолекулярного взаимодействия и т. д. Подробно и основательно все эти вопросы отражены в монографиях, указанных в списке литературы.