Основы термохимии. Тепловые эффекты химических реакций
План
 1. Экзо- и эндотермические реакции.
1. Экзо- и эндотермические реакции.
2. Тепловой эффект химической реакции. Понятие об энтальпии.
3. Термохимические уравнения.
4. Закон Гесса и следствия из него.
Химические реакции протекают с выделением или поглощением энергии (обычно в виде теплоты). Химические реакции, протекающие с выделением теплоты, называются экзотермическими, а реакции, протекающие с поглощением теплоты, – эндотермическими.
Например:
С + О2 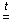 CO2 + Q,
CO2 + Q,
СaCO3 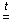 CaO + CO2 – Q.
CaO + CO2 – Q.
Количество теплоты, которое выделяется или поглощается в результате химической реакции, называется тепловым эффектом реакции (Q).
Тепловой эффект выражается в кДж или ккал
(1 ккал = 4,187 кДж). Для экзотермических реакций Q > 0, для эндотермических Q < 0.
Уравнения химических реакций, в которых записывается тепловой эффект реакции, называют термохимическими уравнениями. Величина Q указывается в правой части уравнения со знаком «+» в случае экзотермической реакции и со знаком «–» в случае эндотермической реакции. В термохимическом уравнении принято указывать агрегатные состояния реагентов и продуктов реакции, т.к. тепловой эффект реакции зависит от агрегатных состояний реагирующих веществ. По термохимическим уравнениям можно проводить различные расчеты, поскольку тепловой эффект реакции относится к мольным количествам исходных веществ и продуктов реакции. Также термохимические уравнения можно записывать с величиной изменения энтальпии (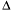 Н).
Н).
Энтальпия – термодинамическая функция, определяющая общий запас энергии системы (энергетическое состояние вещества), включая энергию, затрачиваемую на преодоление внешнего давления. Q = – 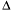 H. Размерность энтальпии – Дж/моль.
H. Размерность энтальпии – Дж/моль.
Например:
С + О2 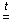 CO2 –
CO2 – 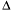 Н,
Н,
СaCO3 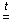 CaO + CO2 +
CaO + CO2 + 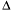 Н.
Н.
Основной закон термохимии установлен русским ученым Г.И.Гессом в 1840 г. (закон Гесса):
тепловой эффект химической реакции зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий процесса.
Например:
С + 1/2О2 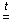 CO + Q 1,
CO + Q 1,
СO + 1/2О2 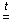 CO2 + Q 2,
CO2 + Q 2,
С + О2 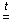 CO2 + Q 3;
CO2 + Q 3;
Q 3 = Q 1 + Q 2.
Первое следствие из закона Гесса:
тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом сумм теплот образования исходных веществ (с учетом коэффициентов):
Q р-ции= Q обр. прод – Q обр. реаг.
Теплота образования (Q обр) – это теплота, которая выделяется или поглощается при образовании
1 моль сложного вещества из простых веществ при стандартных условиях. Теплоты образования простых веществ приняты равными нулю.
Стандартные условия – давление 1 атм (101,3 кПа), Т = 298К (25 °С).
Второе следствие из закона Гесса:
тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции (с учетом коэффициентов):
Q р-ции = Q сгор. реаг – Q сгор. прод.
Теплота сгорания (Q сгор) – это теплота, выделяющаяся при сгорании 1 моль вещества в кислороде при стандартных условиях с образованием оксида элемента в высшей степени окисления. Теплоты сгорания негорючих веществ равны нулю.
Теплоты сгорания и образования – справочные величины, они приводятся в справочных термодинамических таблицах при стандартных условиях.
Тест по теме
«Основы термохимии. Тепловые эффекты химических реакций»
1. При стандартных условиях теплота образования равна 0 для:
а) водорода;
б) воды;
в) пероксида водорода;
г) алюминия.
2. Реакция, уравнение которой
N2 + O2 = 2NO – Q,
относится к реакциям:
а) эндотермического соединения;
б) экзотермического соединения;
в) эндотермического разложения;
г) экзотермического разложения.
3. При взаимодействии 10 г натрия с водой выделяется 36,46 кДж теплоты. Какое количество теплоты (в кДж) выделилось, если в результате реакции образовалось 200 г гидроксида натрия?
а) 838; б) 209,5; в) 364,6; г) 419.
4. Эндотермической является реакция:
а) горения водорода; б) разложения воды;
в) горения углерода; г) горения метана.
5. Известны тепловые эффекты следующих процессов:
2С2Н2 (г.) + 5О2 (г.) = 4СО (г.) + 2Н2О (ж.) + 2600 кДж,
Н2О (ж.) = Н2О (г.) – 40 кДж.
Какую массу воды (в г), находящейся при температуре кипения, можно испарить за счет теплоты, полученной при полном сгорании 89,6 л (н.у.) ацетилена?
а) 72; б) 1170; в) 2340; г) 4680.
6. Какое определение неверно для данной реакции:
2NaNO3 (тв.) = 2NaNO2 (тв.) + O2 (г.) – Q?
а) Гомогенная;
б) эндотермическая;
в) реакция соединения;
г) окислительно-восстановительная.
7. Даны теплоты реакций:
С + 1/2О2 = СО + 110 кДж,
2СО + О2 = 2СО2 + 566 кДж.
Определить теплоту образования углекислого газа из простых веществ (в кДж/моль).
а) 346; б) 786; в) 503; г) 393.
8. Дано термохимическое уравнение:
2SO2 + O2 = 2SO3 + 198 кДж.
В результате реакции выделилось 495 кДж теплоты. Какая масса (в г) сернистого газа прореагировала с кислородом?
а) 160; б) 640; в) 320; г) 320.
9. Теплота сгорания ацетилена – 1300 кДж/моль. Какое количество теплоты (в кДж) выделится при сгорании 1л ацетилена (в пересчете на н.у.)?
а) 58; б) 116; в) 1300; г) 58 000.
10. Основным законом термохимии является закон:
а) Гей-Люссака; б) Гесса;
в) Авогадро; г) Пруста.
Ключ к тесту
| а, г | а | г | б | в | а, в | г | в | а | б |