 1. Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль.
1. Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль.
Решение

Ответ. 65,3 кДж/моль.
2. Найти теплоту образования угарного газа, если теплота образования углекислого газа равна +393,8 кДж/моль, а теплота реакции получения углекислого газа из угарного газа и кислорода равна +283,2 кДж/моль.
Ответ. +110,6 кДж/моль.
3. Теплота сгорания графита составляет +393,8 кДж/моль, а теплота сгорания алмаза равна
+395,7 кДж/моль. Определить теплоту превращения графита в алмаз.
Ответ. –1,9 кДж/моль.
4. Теплота образования бромоводорода равна +36 кДж/моль, теплота образования йодоводорода равна +12,6 кДж/моль. Рассчитать тепловой эффект реакции взаимодействия йодоводорода с бромом.
Ответ. +23,4 кДж/моль.
5. Теплота образования углекислого газа равна +393,8 кДж/моль, теплота образования воды равна
+285,8 кДж/моль, теплота сгорания этилена равна +1402 кДж/моль. Вычислить теплоту образования этилена.
Ответ. –42,8 кДж/моль.
6. Определить тепловой эффект реакции разложения 1 моль известняка, если при образовании 10 г карбоната кальция из оксида кальция и углекислого газа выделяется 16 кДж теплоты.
Ответ. –160 кДж/моль.
7. Термохимическое уравнение реакции горения метана имеет вид:
СН4 (г.) + 2О2 (г.) = СО2 (г.) + 2Н2О (г.),
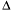 Н = –802,2 кДж.
Н = –802,2 кДж.
Найти, какое количество теплоты выделится при сгорании 44,8 л (н.у.) метана.
Ответ. 1604,4 кДж.
8. При соединении 11,16 г железа с серой выделилось 20,06 кДж теплоты. Определить теплоту образования сульфида железа.
Ответ. 100,3 кДж/моль.
9. Термохимическое уравнение реакции окисления водорода имеет вид:
|
|
Н2 (г.) + 1/2О2 (г.) = Н2О (г.),
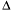 Н = –241,8 кДж.
Н = –241,8 кДж.
Определить количество теплоты, выделяющейся при взрыве 8,4 л (н.у.) гремучего газа.
Ответ. 60,45 кДж.
10. При сгорании этилена выделилось 6226 кДж теплоты. Найти объем (н.у.) кислорода, вступившего в реакцию, если тепловой эффект данной реакции составляет 1410,9 кДж. Ответ. 296,5 л.
11. Окисление глюкозы в организме может протекать по реакции:
С6Н12О6 (тв.) + 6О2 (г.) = 6СО2 (г.) + 6Н2О (ж.),
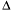 Н = –2803 кДж.
Н = –2803 кДж.
Какое количество теплоты выделится при окислении 800 г глюкозы?
Решение

Ответ. 12 458 кДж.
12. При стандартных условиях теплота полного сгорания белого фосфора равна 760,1 кДж/моль, а теплота полного сгорания черного фосфора равна 722,1 кДж/моль. Определить теплоту превращения черного фосфора в белый при стандартных условиях.
Ответ. –38 кДж/моль.
13. При сжигании уксусной кислоты в кислороде выделилось 235,9 кДж теплоты и осталось 10 л непрореагировавшего кислорода (измерено при давлении 104,1 кПа и температуре 40 °С). Рассчитать массовые доли компонентов в исходной смеси, если теплоты образования углекислого газа, паров воды и уксусной кислоты равны соответственно 393,5 кДж/моль, 241,8 кДж/моль и
484,2 кДж/моль.
Ответ. 36% СН3СООН и 64% О2.
14. 48 г минерала, содержащего 46,7% железа и 53,3% серы по массе, сожгли в избытке кислорода, а твердый продукт сгорания прокалили с 18,1 г алюминия. Какое количество теплоты выделилось в результате каждого из этих процессов, если известно, что реакции проводились при постоянной температуре, а теплоты образования при данной температуре таковы: сульфид железа – 174 кДж/моль, оксид железа(III) – 824 кДж/моль, сернистый газ – 297 кДж/моль, оксид алюминия – 1675 кДж/моль?
|
|
Ответ. 332,8 кДж и 170,2 кДж.
15. Тонко измельченную смесь алюминия и железной окалины (термит) применяют для сварки металлических изделий, поскольку при ее поджигании выделяется большое количество теплоты и развивается высокая температура. Рассчитать минимальную массу термитной смеси, которую необходимо взять для того, чтобы выделилось 665,3 кДж теплоты в процессе алюмотермии, если теплоты образования железной окалины и оксида алюминия равны 1117 кДж/моль и 1670 кДж/моль соответственно.
Ответ. 182,4 г.