Контрольные задания для заочников по дисциплине «Аналитическая химия» для студентов всех специальностей заочной формы обучения
Вариант 1
1. Рассчитать рН: а) 0,01 М HF; б) 0,25М Са(ОН)2; в) 0,01 М CH3COONa (КК-ТЫ= 1,74∙10-5, рК=4,76).
2. Назвать кислоты и основания по теории Бренстеда-Лоури: НСО  ; ClO
; ClO  ; H2S; RbOH.
; H2S; RbOH.
3. Рассчитать молярную концентрацию раствора НСl, титр которого по КОН равен 0,01353 г/мл.
4. Рассчитать массу навески бихромата калия (х.ч.) для приготовления 250,0 мл раствора с титром по железу 0,006295 г/мл.
5. На титрование навески янтарной кислоты массой 0,1562г израсходовали 21,05 мл раствора NaOH. Рассчитать C(NaOH), T (NaOH) и Т (NaOH/H2SО4).
Вариант 2
1. Рассчитать рН: а) 0,01 М НВr; б) 0,15 М N2H4; в) 0,01 М НСООН.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: НСlO3; СО32-; HS-; NH4+.
3. Рассчитать молярную концентрацию 13,73%-го раствора NaOH.Н
4. Навеску йода (х.ч.) массой 1,262 г растворили в мерной колбе емкостью 250,0 мл. Рассчитать С(1/2 J2), T(J2) и Т(J2/Na2S2O3 • 5Н2O).
5. Какую массу щавелевой кислоты Н2С2O4 • 2Н2O необходимо взять, чтобы на её титрование израсходовать 20,00 мл 0,1020 М NaOH.
Вариант 3
1. Рассчитать рН: а) 0,001 М HJ; б) 0,15 М С6Н5СН2NH2; в) 0,2 M NH4Cl.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: SO32-; Na2HPO4; Ba(OH)2; HJ.
3. В 100,0 мл раствора содержится 1,862 г буры. Рассчитать титр и молярную концентрацию этого раствора.
4. Рассчитать массу навески (NH4)2C2O4 (х.ч.) для приготовления 500,0 мл раствора с титром 0,01216 г/мл.
5. Навеску бензойной кислоты массой 0,1495 г оттитровали 22,15 мл раствора КОН. Рассчитать титр и молярную концентрацию раствора КОН.
Вариант 4
1. Рассчитать рН: а) 0,01 М HNO3; б) 0,15 М CH3NH2; в) 0,2 М Na2CO3.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: NО3-; СН3ОН; НСО3-; NH4+.
3. Рассчитать титр 17,45 %-го раствора НСl.
4. Рассчитать массу навески буры для приготовления 250,0 мл 0,1М (fэкв = 1/2) раствора.
5. На титрование навески щавелевой кислоты массой 0,1325 г израсходовали 20,00 мл раствора NaOH. Рассчитать C(NaOH), T(NaOH) и Т (NaOH/H2SO4).
Вариант 5
1. Рассчитать рН: а) 0,25 М С6Н5СООН; б) 0,001 М КОН; в) 0,05 М NaNO2.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: Н2O; Н3РO4; C2H5NH2; НSО43-.
3. Рассчитать молярную концентрацию 13,28%-го раствора NaOH.
4. Рассчитать навеску безводной соды, необходимую для приготовления 500,0 мл 0,05 М (fэкв=1/2) раствора.
5. На титрование раствора, полученного из 0,4462 г Na2B4O7 • 10Н2О (х.ч.), израсходовали 14,25 мл раствора НСl. Рассчитать С(НСl), Т (НСl) и Т (HCl/K2O).
Вариант 6
1. Рассчитать рН: а) 0,01 М HCN; б) 0,05 М NH3; в) 0,25 М СН3СООNа.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: NaHCO3; РO43-; Сu(ОН)2; H2SO4.
3. Рассчитать молярную концентрацию и титр 48,45 %-го раствора H2SO4.
4. Какой объем НСl ( =1,165 г/мл) необходим для приготовления 500,0 мл раствора с титром 0,003420 г/мл.
=1,165 г/мл) необходим для приготовления 500,0 мл раствора с титром 0,003420 г/мл.
5. Для установки титра НСl навеску Na2C2O4 массой 0,1167 г прокалили до постоянной массы (Na2C2O4 = Nа2СО3 + СО) и оттитровали 18,75 мл раствора НСl. Рассчитать Т(НСl) и T(HCl/NaOH).
Вариант 7
1. Рассчитать рН: а) 0,01 М Н2СО3; б) 0,15 М C2H5NH2; в) 0,05 М NH4NО3.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: NН2ОН; НСlO3; ZnOHCl; HSO4-.
3. Сколько мл 13,50%-го раствора соляной кислоты (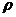 = 1,090 г/мл) необходимо для приготовления 250,0 мл раствора с T(HCl/NaOH)=0,004242 г/мл.
= 1,090 г/мл) необходимо для приготовления 250,0 мл раствора с T(HCl/NaOH)=0,004242 г/мл.
4. Рассчитать массу навески трилона Б для приготовления 250,0 мл 0,05 М (fэкв= 1/2) раствора.
5. Рассчитать С (НСl) и Т (НСl), если на титрование 0,4862 г Na2CO3 израсходовали 10,12 мл кислоты.
Вариант 8
1. Рассчитать рН: а) 0,1 М HNO2; б) 0,01 М Са(ОН)2; в) 0,25 М НСlO4.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: NaOH; NH4COOH; HCN; C5H5N.
3. Рассчитать Т (HCl/K2O), если Т (НСl)=0,05798 г/мл.
4. Рассчитать массу навески К2Сг2O7 (х.ч.) для приготовления 250,0 мл раствора с титром 0,009811 г/мл.
5. Навеску Н2С2O4 • 2Н2О массой 0,5012 г растворили в мерной колбе емкостью 100,0 мл. На титрование 20,00 мл полученного раствора израсходовали 18,34 мл NaOH. Рассчитать C(NaOH) и Т (NaOH/ H2C2O4).
Вариант 9
1. Рассчитать рН: а) 0,01 М СН3СООН; б) 0,15 М NH4Cl; в) 0,05 М NаНСО3.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: С2Н5OН; (NH4)2S; Ba(OH)2; НСО3-.
3. Рассчитать Т(Nа2S2O3), если Т(Na2S2О3/J2) = 0,01554 г/мл.
4. Рассчитать массу навески бихромата калия (х.ч.) для приготовления 250,0 мл 0,05 М (fэкв= 1/6) раствора.
5. Рассчитать С(НNО3), если на титрование 20,00 мл раствора кислоты израсходовали 21,12 мл раствора NaOH с титром по Н2С2O4 0,005490 г/мл.
Вариант 10
1. Рассчитать рН: а) 0,1 М HCN; б) 0,25 М Ва(ОН)2; в) 0,05 М NH4Cl.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: SO42-; Н2СО2; Sr(OH)2; NaHS.
Рассчитать массу навески буры (х.ч.) для приготовления 100,0 мл раствора с титром по НС1 0,003225 г/мл.
4. В 250,0 мл раствора содержится 1,329 г Nа2СО3. Рассчитать Т(Na2CO3), Т(Nа2СО3Сl) и С(1/2 Nа2СО3) при нейтрализации этого раствора до СО2.
5. Для определения P2O5 в суперфосфате (Н3РO4 титруется до КН2РO4) приготовили раствор КОН. На титрования 18,00 мл 0,1 М НС1 (К=0,9065) израсходовали 19,32 мл КОН. Рассчитать Т(КОН/Р2O5).
Вариант 11
1. Рассчитать рН: а) 0,01 М НClO3; б) 0,15 М KCN; в) 0,05 М NaH2PO4 + 0,200 M Na2HPO4.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: Са(НСО3)2; НВr; С1O4-; Н2РO4-.
3. Рассчитать титр 18,25 %-го раствора NaOH.
4. Рассчитать массу навески Н2С2O4 • 2Н2O, необходимую для приготовления 200,0 мл 0,1 М раствора.
5. Рассчитать молярную концентрацию раствора КОН, если на титрование 15,00 мл его израсходовали 18,70 мл раствора НСl с титром 0,002864 г/мл.
Вариант 12
1. Рассчитать рН: а) 0,05 М НСlO3; б) 0,01 М NH4Br; в) 0,1 М NH4OH.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: ZnOHCl; NH4+; HSO4-; NH3.
3. В 100,0 мл раствора содержится 0,5316 г Na2CO3. Рассчитать C(Na2CO3), C(1/2Na2CO3), T(Na2CO3) и T(Na2CO3/HCl).
4. Сколько граммов буры (х.ч.) необходимо для приготовления 500,0 мл концентрацией 0,1 моль экв/л.
5. На титрование 0,1050 г Na2СО3 (х.ч.) израсходовали 22,50 мл НСl. Рассчитать титр и молярную концентрацию раствора НСl.
Вариант 13
1. Рассчитать рН: а) 0,1 М С3Н7СООН; б) 0,01 М LiOH; в) 0,02 М KF.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: КОН; НСО3-; NH4COOH; H2SO4.
3. Из 0,7586 г Н2С2O4 • 2Н2О приготовили 250,0 мл раствора. Рассчитать С(1/2 Н2С2O4) Т(Н2С2O4), Т(Н2С2O4/КМnO4).
4. Рассчитать массу навески буры, необходимую для приготовления 500,0 мл раствора концентраций 0,15 моль экв/л.
5. Из навески щелочи массой 0,5341 г, содержащей 92,00 % NaOH, получили 100,0 мл раствора. Рассчитать С (НСl) и Т (НСl), если на титрование 15,00 мл раствора NaOH израсходовали 19,20 мл кислоты.
Вариант 14
1. Рассчитать рН: а) 0,25 М СН3NН2; б) 0,1 М НМnO4; в) 0,01 М NH4J.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: СН3ОН; LiOH; С6Н5СООNН4; Н3О+.
3. Титр раствора НСl равен 0,03647 г/мл. Рассчитать молярную концентрацию раствора и титр по КОН.
4. Сколько граммов Na2C2O4 (х.ч.) необходимо для приготовления 250,0 мл с титром по KMnO4 0,04532 г/мл.
5. Навеску безводной соды (х.ч.) массой 5,206 г растворили в мерной колбе ёмкостью 500,0 мл. На титрование 15,00 мл полученного раствора израсходовали 14,15 мл раствора НСl. Рассчитать С (НСl), Т (НСl), T(HCl/NaOH).
Вариант 15
1. Рассчитать рН: а) раствора, содержащего 4,1г CH3COONa в 0,5 л; б) 0,05 М Ва(ОН)2; в) 0,1 М С6Н5СООН.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: Na2HPO4; CsOH; HMnO4; СО32-.
3. К 550,0 мл 0,1825 М НСl прибавили 50,00 мл раствора НСl с титром 0,023554 мл. Рассчитать молярную концентрацию и титр полученного раствора.
4. Сколько граммов безводной соды (х.ч.) необходимо для приготовления 500,0 мл раствора концентраций 0,1 моль экв/л.
5. Навеску Н2С2O4 • 2Н2O массой 0,6215 г растворили в мерной колбе емкостью 100,0 мл. На титрование 10,00 мл полученного раствора израсходовали 10,20 мл раствора NaOH. Рассчитать C(NaOH) и T(NaOH).
Вариант 16
1. Рассчитать рН: а) раствора, содержащего 5 г/л NH2OH; б) 0,1 М Sr(OH)2; в) 0,001M HNO3.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: Н2О; Са(ОН)2; NaHCO3; СН3СООН.
3. Рассчитать молярную концентрацию НСl, если Т (НСl/КОН) = 0,01564 г/мл.
4. Рассчитать массу навески буры (х.ч.) для приготовления 100,0 мл раствора с титром 0,005260 г/мл.
5. На титрование 0,1282 г Н2С2O4 • 2H2O израсходовали 17,50 мл раствора КОН. Рассчитать С (КОН), Т (КОН) и Т (КОН/НСl).
Вариант 17
1. Рассчитать рН: а) раствора, содержащего 7 г/л СН3СООН; б) 0,05 М CsNO2; в) 0,15 М Са(ОН)2.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: NH2CH2COOH; НСООН; NaH2PO4, Cl-.
3. Рассчитать Т(КМnO4) и С(1/5 КМnO4), если T(KMnO4/Fe)=0,004005 г/мл.
4. Какой объем НСl (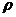 =1,19 г/мл) необходим для приготовления 1л 0,1 М раствора.
=1,19 г/мл) необходим для приготовления 1л 0,1 М раствора.
5. Навеску Nа2В4O7 • 10 Н2О (х.ч.) растворили в мерной колбе емкостью 250,0 мл. На титрование 20,00 мл приготовленного раствора израсходовали 19,50 мл раствора H2SO4. Рассчитать Т (H2SO4) и С (1/2 H2SO4).
Вариант 18
1. Рассчитать рН: а) раствора, содержащего 1,12 г КОН в 100,0 мл воды; б) 0,0250 М HNO2; в) 0,1000 М Ва(ОН)2.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: С3Н7СООН; KHSO4; NН3, H3O+.
3. Рассчитать молярную концентрацию 27,00%-го раствора HNO3 (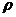 = 1,215 г/мл)
= 1,215 г/мл)
4. Сколько граммов трилона Б необходимо для приготовления 250,0 мл раствора концентрацией 0,05 моль экв/л.
5. На титрование раствора, содержащего 0,2524 г безводной соды, израсходовали 20,50 мл раствора Н2SO4. Рассчитать Т(Н2SO4) и T(H2SO4/NaOH).
Вариант 19
1. Рассчитать рН: а) раствора, содержащего 4,5 г СН3СООН в 750,0 мл; б) 0,1 М НСlO4; в) 0,25 М CH3NH2.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: HJ; С2Н5OН; NO3-; CuOHCl.
3. Рассчитать титр и молярную концентрацию эквивалента раствора К2Сr2O7, если Т(К2Сr2O7/Fе)=0,005235 г/мл.
4. Сколько граммов тетрабората натрия необходимо для приготовления 100,0 мл раствора с титром по НСl 0,004578 г/мл.
5. Для установки титра соляной кислоты навеску Na2C2O4 массой 0,0862 г прокалили в платиновом тигле до постоянной массы (Nа2С2O4 = Na2CO3 + СО) и на её титрование израсходовали 13,80 мл кислоты. Рассчитать Т(НСl) и Т(НСl/КОН).
Вариант 20
1. Рассчитать рН: а) 0,025 М C2H5NH2; б) 0,01 М NaOH; в) раствора, содержащего 2,658 г Na2CO3 в 500,0 мл воды.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: Вr-; С3Н7OН; HMnO4; HS-.
3. Рассчитать молярную концентрацию раствора НСl, плотность которого равна 1,075 г/мл.
4. Рассчитать массу навески Н2С2O4 • 2Н2O для приготовления 500,0 мл раствора с титром по КМnO4 0,005835 г/мл.
5. На титрование навески янтарной кислоты массой 0,1245 г израсходовали 18,50 мл раствора NaOH. Рассчитать С (NaOH) и Т (NaOH).
Вариант 21
1. Рассчитать рН раствора, полученного при смешении; а) 20,00 мл 0,1 М НСl и 15,00 мл 0,2 М КОН; б) 10,00 мл 0,05 М NH4OH и 5,00 мл 0,05 М НСl.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: NН3; НNО3; СН3СОО-; СН3ОН.
3. Рассчитать молярную концентрацию 31,40 %-го раствора H2SO4.
4. Рассчитать массу навески буры для приготовления 100,0 мл раствора с титром по HCl 0,005318 г/мл.
5. К навеске Nа3РO4 массой 0,1016 г прибавили 25,00 мл 0,1005 М H2SO4. На титрование избытка кислоты с метиловым оранжевым израсходовали 15,20 мл раствора NaOH. Рассчитать С (NaOH).
Вариант 22
1. Рассчитать рН раствора, полученного при смешении: а) 50,00 мл 0,05 М НСООН и 50,00 мл 0,05 М НСООNa; б) 32,00 мл 0,25 М НСlO4 и 19,00 мл 0,4 М КОН.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: NaH2PO4; NH4+; Ba(OH)2; Н2О.
3. Сколько мл 16,47%-го раствора НСl (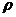 = 1,080 г/мл) необходимо для приготовления 500,0 мл 0,1 М раствора.
= 1,080 г/мл) необходимо для приготовления 500,0 мл 0,1 М раствора.
4. Рассчитать массу навески безводной соды (х.ч.) для стандартизации раствора 0,1 М НСl методом отдельных навесок.
5. Из навески янтарной кислоты (х.ч.) массой 0,4826 г приготовили 250,0 мл раствора, на титрование 10,00 мл которого израсходовали 10,10 мл раствора NaOH. Рассчитать C(NaOH), T(NaOH) и T(NaOH/H2SO4).
Вариант 23
1. Рассчитать рН раствора, содержащего: а) 2,800 г КОН в 500 мл; б) 2,050г CH3COONa в 250,0 мл.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: Na2CO3; Н3РO4; С2Н5OН; ZnOHCl.
3. Сколько мл 21,00%-го раствора НNО3 (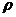 = 1,125 г/мл) необходимо для приготовления 250,0 мл раствора с Т (НNО3) = 0,006678 г/мл.
= 1,125 г/мл) необходимо для приготовления 250,0 мл раствора с Т (НNО3) = 0,006678 г/мл.
4. Какую массу Н2С2O4 • 2Н2O необходимо взять, чтобы на её титрование израсходовать 19,85 мл 0,1 М NaOH (К = 1,012).
5. Для определения P2O5 в фосфорной кислоте навеску её массой 1,027 г растворили в мерной колбе емкостью 100,0 мл. На титрование 10,00 мл полученного раствора израсходовали 9,10 мл 0,1М раствора КОН (К = 0,9839). Рассчитать массовую долю (%) Н3РO4 и P2O5 в образце.
Вариант 24
1. Рассчитать рН: а) 0,1 М Na2CO3; б) 5%-го раствора НСl; в) 5%-го раствора СН3СООН.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: NН3; NаНСО3; HCl; NH4Cl.
3. Сколько мл H2SO4 (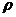 = 1,510 г/мл) необходимо для приготовления 500,0 мл раствора с Т(H2SO4/Nа2СО3) = 0,004980 г/мл.
= 1,510 г/мл) необходимо для приготовления 500,0 мл раствора с Т(H2SO4/Nа2СО3) = 0,004980 г/мл.
4. Рассчитать массу навески щавелевой кислоты (х.ч.) для приготовления 100,0 мл 0,1М (fэкв= 1/2) раствора.
5. К 100,0 мл воды прибавили 20,00 мл раствора Nа2СО3 с титром по СаО 0,003020 г/мл, смесь прокипятили и после отделения осадка карбонатов кальция и магния избыток Nа2СО3 оттитровали 17,25 раствора HCl (20,00 мл раствора Nа2СО3 эквивалентны 21,00 мл раствора HCl). Рассчитать постоянную жесткость воды.
Вариант 25
1. Рассчитать рН: а) раствора, содержащего 5 г/л НСl; б) раствора, полученного при смешении равных объемов 0,1 М Н2С2O4 и 0,2 М NaOH.
2. Назвать кислоты и основания по теории Бренстеда-Лоури: Н2СО3, J-; HS-, NH4+.
3. Сколько мл 35,60 %-го раствора H2SO4 необходимо для приготовления 500,0 мл 0,25 М раствора.
4. Какая масса вещества, содержащего 92 % Na2CO3 необходима чтобы на титрование с метиловым оранжевым израсходовать 19,85 мл 0,1205 М НСl?
5. Из навески фосфорной кислоты массой 2,594 г (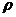 = 1,580 г/мл) приготовили 250,0 мл раствора, на титрование 20,00 мл которого с метиловым оранжевым израсходовали 17,95 мл раствора NaOH. Рассчитать C(NaOH) и T(NaOH).
= 1,580 г/мл) приготовили 250,0 мл раствора, на титрование 20,00 мл которого с метиловым оранжевым израсходовали 17,95 мл раствора NaOH. Рассчитать C(NaOH) и T(NaOH).