Законы сохранения массы и энергии в макроскопических процессах
ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ
Рассмотрим систему, состоящую из N взаимодействующих друг с другом частиц, находящихся под воздействием внешних как консервативных, так и неконсервативных сил. Силы взаимодействия между частицами предполагаются консервативными. Определим работу, совершаемую над частицами при перемещении системы из одного места в другое, сопровождающимся изменением конфигурации системы.
Работа внешних консервативных сил может быть представлена как убыль потенциальной энергии системы  во внешнем силовом поле:
во внешнем силовом поле:

где  определяется формулой (9).
определяется формулой (9).
Работа внутренних сил равна убыли взаимной потенциальной энергии частиц:
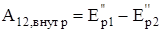 ,
,
где  – потенциальная энергия системы во внешнем поле сил.
– потенциальная энергия системы во внешнем поле сил.
Работу неконсервативных сил обозначим  .
.
Согласно формуле (7) суммарная работа всех сил затрачивается на приращение кинетической энергии системы Ek, которая равна сумме кинетических энергий частиц:
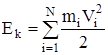
Следовательно,
 .
.
Сгруппируем члены этого соотношения следующим образом:
 .
.
Сумма кинетической и потенциальной энергий представляет собой полную механическую энергию системы E:
 .
.
Таким образом, мы установили, что работа неконсервативных сил равна приращению полной энергии системы:
 (11)
(11)
Из (11) следует, что в случае, когда неконсервативные силы отсутствуют, полная механическая энергия системы остается постоянной:
 .
.
Мы пришли к закону сохранения механической энергии, который гласит, что полная механическая энергия системы материальных точек, находящихся под действием только консервативных сил, остается постоянной.
Если система замкнута и силы взаимодействия между частицами консервативны, то полная энергия содержит только два слагаемых:  (
( - взаимная потенциальная энергия частиц). В этом случае закон сохранения механической энергии заключается в утверждении, что полная механическая энергия замкнутой системы материальных точек, между которыми действуют только консервативные силы, остается постоянной.
- взаимная потенциальная энергия частиц). В этом случае закон сохранения механической энергии заключается в утверждении, что полная механическая энергия замкнутой системы материальных точек, между которыми действуют только консервативные силы, остается постоянной.
В основе закона сохранения энергии лежит однородность времени, т.е. равнозначность всех моментов времени, заключающаяся в том, что замена момента времени t1 моментом времени t2 без изменения значений координат и скоростей тел не изменяет механических свойств системы. Поведение системы, начиная с момента t2, будет таким же, каким оно было бы, начиная с момента t1.
Закон сохранения энергии имеет всеобщий характер. Он применим ко всем без исключения процессам, происходящим в природе. Полное количество энергии в изолированной системе тел и полей всегда остается постоянным; энергия лишь может переходить из одной формы в другую. Этот факт является проявлением не уничтожаемости материи и ее движения.
Самоорганизация химических систем и энергетика химических процессов
Способность к взаимодействию различных химических реагентов определяется не только их атомарно-молекулярной структурой, но и условиями протекания химических реакций.
К условиям протекания химических процессов относятся: термодинамические факторы (температура, давление), наличие катализаторов и других добавок к реагентам, влияние растворителей, стенок реакторов и др. Указанные условия могут оказывать воздействие на характер и результат химических реакций при определенной структуре молекул химических соединений. Наиболее активны в этом отношении соединения переменного состава с ослабленными связями между их компонентами. Взять, например, реакцию синтеза из азота и водорода. Вначале его не удавалось получить ни с помощью большого давления, ни высокой температуры, и только использование в качестве катализатора специально обработанного железа впервые привело к успеху. В присутствии металлоорганического катализатора синтез аммиака происходит при обычной температуре (18 °С) и нормальном атмосферном давлении. Это открывает большие перспективы не только для производства удобрений, но в будущем такого изменения генной структуры злаков (ржи, пшеницы), когда они не будут нуждаться в азотных удобрениях.
Следует отметить, что возникновение и эволюция жизни на Земле были бы невозможны без существования ферментов, служащих по сути дела живыми катализаторами. Однако, они функционируют только в рамках живой природы. Попытки перенести опыт живой природы на неорганический мир наталкиваются на серьезные ограничения.
Тот факт, что катализ играл решающую роль в процессе перехода от химических систем к биологическим, т.е. на предбиотической стадии эволюции, в настоящее время подтверждается многими данными и аргументами. Наиболее убедительные результаты связаны с опытами по самоорганизации химических систем, которые наблюдали наши ученые Борис Павлович Белоусов и Алексей Михайлович Жаботинский. Их трудами была открыта колебательная химическая реакция. Б.П. Белоусов сделал простой эксперимент. Он приготовил раствор, состоящий из лимонной кислоты (2,0 г.), серной кислоты (1:3) и 20 мл воды. Раствор периодически менял окраску: становился то желтым, то бесцветным. Впервые был открыт «химический маятник». Хотя на несколько лет это открытие было предано забвению, однако в 1970 г. А.М. Жаботинский повторил этот опыт и подтвердил открытие «химического маятника». Такие реакции сопровождаются образованием специфических пространственных и временных структур за счет поступления новых и удаления использованных химических реагентов. Однако в отличие от самоорганизации открытых физических систем в указанных химических реакциях важное значение приобретают каталитические процессы. Роль этих процессов усиливается по мере усложнения состава и структуры химических систем.
В настоящее время открыто более 50 автоволновых химических и биологических реакций, аналогичных реакции Белоусова – Жаботинского, часть из них – цветныеили флуоресцентные, что делает возможным непосредственное наблюдение и использование как аналоговых вычислительных устройств. На этом основании некоторые ученые связывают химическую эволюцию с самоорганизацией и саморазвитием каталитических систем. Однако, следует иметь ввиду, что переход к простейшим формам жизни возможен только при особом дифференциальном отборе таких химических элементов и их соединений, которые являются основным строительным материалом для образования биологических систем. В связи с этим достаточно отметить, что из более чем ста химических элементов лишь шесть (С, О2, Н2, S, СО, N), названных органогенами, служат основой для построения живых систем.
Выдающимся достижением химии является открытие цепных реакций еще до того, как в физике был обнаружен радиоактивный распад.
Суть цепной реакции Н.Н. Семенов описывает так: «Энергии кванта достаточно для того, чтобы двухатомная молекула хлора распалась на отдельные атомы. Каждый из них активнее первоначальной молекулы и поэтому легко вступает в реакцию с молекулой водорода. Она также двухатомна (рис.).

Схема цепной химической реакции
Один из атомов вместе с атомом хлора дает молекулу продукта-хлористого водорода, а другой атом водорода остается свободным. Теперь он легко вступает в реакцию с ближайшей молекулой хлора, образуя вторую молекулу хлористого водорода и отдельный атом хлора. Это повторяется много-много раз, возникает как бы длинная цепь реакций. Теория разветвленных цепных реакций дала начало новому направлению исследований – химической физике, дисциплине, промежуточной между физикой и химией.