Образец.
Краткие теоретические сведения
Закон Гесса для стандартных условий (температура 298 К и давление 101325 Па):
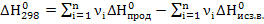 (1)
(1)
Для расчетов теплового эффекта реакции при любой температуре ( ) применяют интегральную форму закона Кирхгофа:
) применяют интегральную форму закона Кирхгофа:
 (2)
(2)
Где  - разность сумм теплоемкостей конечных и начальных веществ с их стехиометрическими коэффициентами:
- разность сумм теплоемкостей конечных и начальных веществ с их стехиометрическими коэффициентами:
 (3)
(3)
кон. нач.
Для проведения точных расчетов надо учитывать зависимости теплоемкости веществ от температуры, например:
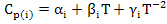 (4)
(4)
Где  – коэффициенты, имеющие определенное численное значение для каждого вещества. В результате осуществления реакции изменение теплоемкости системы:
– коэффициенты, имеющие определенное численное значение для каждого вещества. В результате осуществления реакции изменение теплоемкости системы:
 (5)
(5)
А уравнение закон Кирхгофа приобретает вид:
 (6)
(6)
Изменение энтропии системы, в которой протекает реакция, находя по следующей формуле (для стандартных условий):
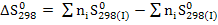 (7)
(7)
кон. нач.
При температуре, отличающейся от стандартной, изменение энтропии рассчитывают по уравнению:
 (8)
(8)
При любой температуре и стандартных давлениях газообразных веществ изменение энергии Гиббса реакции рассчитывают с учетом температурных зависимостей теплового эффекта и энтропии по уравнению Гиббса-Гельмгольца:
 (9)
(9)
А для равновесной температуры находят изменение энергии Гиббса по уравнению:
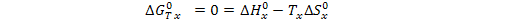 (10)
(10)
Константу равновесия для данной температуры вычисляют по величине изменения энергии Гиббса, используя следующее уравнение термодинамики:
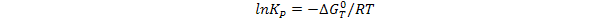 (11)
(11)
Исходные данные
Таблица 1. Химические реакции для термодинамических расчетов
| Номер задания | Уравнение реакции | T, К |
| 3Fe(тв) + 4H2О(пар) = 4H2(газ) +Fe3O4(тв) |
Таблица 2. Термодинамические свойства веществ (из приложения)
| № п/п | Вещество | 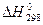 ,
кДж/моль ,
кДж/моль
|  ,
Дж/моль·К ,
Дж/моль·К
| 
| ||
| β | γ | ||||
| Fe | 27,15 | 19,25 | 21,0·10-3 | |||
| H2O(пар) | -241,84 | 188,74 | 30,0 | 10,71·10-3 | 0,33·105 | |
| H2 | 130,6 | 27,28 | 3,26·10-3 | 0,5·105 | ||
| Fe3O4 | -1117,71 | 151,46 | 167,03 | 78,91·10-3 | -41,82·105 |
Расчетная часть
Расчет изменения энтальпии химической реакции при стандартных условиях (298К)
В основе термохимических расчетов лежит закон Гесса: «Тепловой эффект реакции зависит только от конечного и начального состояния веществ и не зависит от промежуточных стадий процесса». Часто в термохимических расчетах используется следствие из закона Гесса: «Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов реакции»:
DH0х.р. = 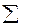 n ´ DH0продуктов -
n ´ DH0продуктов - 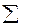 n ´ DH0исходных веществ
n ´ DH0исходных веществ
Распишем тепловой эффект реакции, используя следствие из закона Гесса:
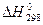 = (4 ´ DH0(H2) + DH0(Fe3O4) - (3 ´ DH0(Fe) + 4 ´ DH0(H2O)
= (4 ´ DH0(H2) + DH0(Fe3O4) - (3 ´ DH0(Fe) + 4 ´ DH0(H2O)
Подставим справочные данные из таблицы 2 получаем:
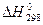 = (0+(-1117,71)) – (0+4*(-241,84)) = -150,35 кДж/моль
= (0+(-1117,71)) – (0+4*(-241,84)) = -150,35 кДж/моль
Вывод: так как полученное значение изменения энтальпии процесса – отрицательная величина, то в результате протекания этой реакции в прямом направлении выделяется теплота и прямая реакция является экзотермической.
Расчет изменения энтальпии химической реакции при заданной температуре (1500 К)
Расчет проводится по формуле Кирхгофа
 , так как теплоемкость выражается уравнением (4), после подстановки получаем:
, так как теплоемкость выражается уравнением (4), после подстановки получаем:

В интегральной форме формула Кирхгофа выглядит следующим образом:
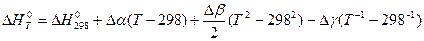
где Δ α, Δ β, Δ γ – изменение величин степенных коэффициентов физико-химической системы в уравнении теплоемкости (4) при протекании химической реакции.
Рассчитываем Δ α, Δ β, Δ γ, например, для Δ α:
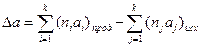 =(4*27,28+167,03)-(3*19,25+4*30) = 98,4
=(4*27,28+167,03)-(3*19,25+4*30) = 98,4
Результаты заносим в таблицу:
| Коэффициент | Значение |
| Δ α | 98,4 |
| Δ β | -0,01389 |
| Δ γ | -4114000 |
Подставляем полученные значения в уравнение для расчета:

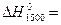 -58145 Дж/моль
-58145 Дж/моль
Вывод: изменение энтальпии при 1500 К относительно теплового эффекта при стандартных условиях имеет меньшее значение, следовательно при температуре 1500 К протекание процесса в прямом направлении сопровождается поглощением теплоты.