Еще в 19-м столетии на новоизготовленных стеклянных термометрах было замечено явление так называемого «векового повышения точки нуля». Это явление вызвано сжатием стекла. Со временем из-за повышения плотности стекла объём резервуара для жидкости уменьшался. При комнатной температуре этот процесс протекают десятилетиями и столетиями, однако он может быть ускорен, если термометр подвергнуть специальной термической обработке (рис. 1.12). При повышенных температурах заметное изменение плотности стекла наблюдается уже в течение нескольких суток.

Рис. 1.12. Изменение с температурой линейного размера образца стекла
Подробно изучено изменение показателей преломления оптических стёкол со временем. Оказалось, что при выдержке показатель преломления стремится к определённой для данной температуры величине. Это значение достигается как после нагревания стекла, так и после охлаждения (рис. 1.13). Время достижения равновесного значения показателя преломления резко возрастает с понижением температуры.
Рис. 1.13. Приближение к конечным значениям показателя преломления при постоянных температурах после резкого охлаждения и нагревания
Изучили методом растяжения стеклянной нити вязкость силикатного стекла. Вязкость со временем стремится к определенной величине при каждой температуре, однако, ход кривых вязкость от времени различен после нагревания и после охлаждения (рис. 1.14).
Na 2 O-CaO-SiO 2; Т=560 º С.

Рис. 1.14. Влияние выдержки на вязкость стекла (1– после нагревания, 2– после охлаждения)
Аналогичные зависимости вязкости, как функции от времени, выявлены для закаленного (2) и отожженного (1) стёкол.
Изменение свойств стекла со временем связывали с постепенным исчезновением механических напряжений. Считали, что под действием внутренних напряжений стекло уменьшает мольный объем, меняются и другие характеристики.
Для проверки этого предположения сравнили плотность закаленного стекла с плотностью порошка этого же стекла. При закалке в стекле возникают внутренние напряжения. При ударе закалённое стекло под действием внутренних напряжений разрушается с образованием мелких осколков. Оказалось, что плотность закаленного стекла составляет 2,4439 г/см 3, плотность дисперсного порошка этого же стекла 2,4446 г/см 3. Действительно, после измельчения плотность стекла несколько увеличилась.
Провели отжиг стеклянного порошка, полученного измельчением закалённого стекла. Оказалось, что после отжига плотность стекла возросла до 2,4620 г/см 3. Изменение плотности стекла, вызванное исчезновением механических напряжений, составляет всего 3,8% от общего изменения плотности стекла, вызванного термической обработкой. Следовательно, при термической обработке в стекле происходят структурно-химические изменения.
Каждой температуре соответствует состояние равновесия внутри стекловидной фазы. Время перехода системы из одного состояния равновесия в новое состояние равновесия обычно называют процессом релаксации. Это активационный процесс, энергия активации тем больше, чем выше вязкость. Расплавленное стекло достигает состояния равновесия за малый, практически незаметный промежуток времени. Для вязкого, малоподвижного и отвердевшего стекла требуются часы, годы и сотни лет. При быстром охлаждении затвердевающего стеклорасплава происходит замораживание высокотемпературной структуры. Охлаждённое до комнатной температуры стекло находится в неравновесном состоянии.
Закалённое стекло отстоит от равновесного состояния значительно дальше, чем отожжённое. При отжиге закалённого стекла протекают два процесса:
1. Изменение структуры, переход её к равновесному состоянию;
2. Исчезновение механических напряжений.
Термообработка сказывается на свойствах стекла при температурах меньших температуры плавления. FG – равновесная кривая (рис1.15). Температуры Т 1 и Т 2 примерно соответствуют температурам Т g и Т f. При температуре Т>Т 2 наблюдается легкоподвижное состояние стекла, практически всегда структура расплава является равновесной. Равновесие устанавливается за время обычных измерений.

Рис. 1.15. Влияние температуры на мольный объем
стекла
Положение точек G и F определяется скоростью охлаждения. Обычно температуры T g и T f находят при стандартной скорости охлаждения. Если скорость охлаждения меньше стандартной, кривая v = f(T) отрывается от равновесной кривой при T<T f, при большей скорости охлаждения отрыв происходит при T>T f.
Температура T 1 несколько выше температуры T g, при T 1 остается заметной вязкое течение стекломассы при ее выдержке. Существенные изменения объёма могут происходить только при определённой доле вязкого течения, т.е. в пределах интервала стеклования. При температурах ниже температуры стеклования вклад вязкого течения ничтожен и процесс лимитируется, в основном, очень медленно протекающей диффузией компонентов.
Кривая FG' – гипотетически мгновенное охлаждение стекла. В твёрдом стекле полностью замораживается состояние F, характерное для температуры Т 2. При выдержке резко охлаждённого стекла при температуре Т 1 стекло сжимается, мольный объем уменьшается до равновесного значения. При снижении скорости охлаждения стекла зависимость мольного объема от температуры приближается к равновесной кривой, кривая FG' изгибается и приближается к FG. Одновременно снижается температура начала отхода кривых охлаждения от равновесной.
Подобным же образом изменяется мольный объём стекла при нагревании. Кривая GF' – гипотетическая кривая мгновенного нагрева стекла. При уменьшении скорости нагревания изгиб становится всё более тупым и кривые нагревания приближаются к равновесной.
Равновесная структура размягчённого стекла при изотермической выдержке устанавливается при протекании различных физико-химических процессов:
1. Растворение ↔ кристаллизация;
2. Растворение ↔ ликвация;
3. Химическая интеграция ↔ химическая дифференциация;
4. Соединение ↔ разложение.
Опишем кратко отдельные физико-химические процессы.
Растворение ↔ кристаллизация.
Термодинамическое равновесие между расплавом (стеклом) и кристаллом возможно при температурах, лежащих между температурами ликвидуса и солидуса. При температурах Т < Т сол фазовое равновесие расплав – кристалл немыслимо.
Если стекло закристаллизовалось, то система переходит в новое устойчивое состояние с образованием межфазных границ. Равновесие в этой системе описывают с учетом энергии границ раздела. 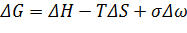
Это классическое уравнение для гетерофазных систем. Здесь σ – межфазная энергия, ∆ω – площадь межфазной поверхности.
Растворение ↔ ликвация.
Равновесие наблюдается как в расплавленных системах при температурах выше температуры ликвидуса (стабильное равновесие), так и в стеклообразных подвижных системах при температурах ниже температуры солидуса (метастабильное равновесие).
Химическая интеграция ↔ химическая дифференциация.
В стёклах это обычно равновесие между сложными и простыми силикатами:
Na x Ca y Si z O (x+y+2z) ↔ xNa 2 Si 2 O 5 + yCaSiO 3 + (z-y-2x)SiO 2
Сложный силикат распадается на дисиликат натрия, волластонит и кремнезём.
Соединение ↔ разложение.
К этим процессам относятся: термическая диссоциация, электролитическая диссоциация, деполимеризация, разрыхление и разупорядочение упаковок атомов.
Обычное промышленное стекло не доходит до истинного равновесия, так как специальной термообработке в высоковязком состоянии, не считая технического отжига, оно не подвергается. Стекло одного и того же состава может иметь различную структуру и свойства соответственно его различной степени приближения к равновесию. Строго определённые свойства отвечают только равновесному состоянию стекла.
Равновесие при выдержке размягчённого стекла достигается в тех случаях, когда химические процессы заканчиваются до того, как возникнут центры кристаллизации или ликвации, превышающие критические размеры. Приближение стекла к состоянию равновесия связано с изменением структуры, оно не имеет ничего общего с разрушением структуры, т.е. с кристаллизацией и отличается от ликвации.
Истинно стабильное равновесие характеризуется двумя признаками:
1. Неизменность свойств системы во времени;
2. Равновесное состояние может быть достигнуто как при увеличении свойства, так и при его уменьшении.
При охлаждении расплавленного стекла выделяют три характерных интервала температур:
1. При высоких температурах подвижность атомов и ионов стеклообразного тела высока и при охлаждении вслед за изменением температуры изменяется и структура вещества.
2. При понижении температуры мы попадаем в область, где структурные изменения перестают успевать за изменением температуры. Подвижность частиц уменьшилась, но она ещё достаточна, чтобы менялась структура вещества. Этот разрыв скорости охлаждения и скорости изменения структуры возрастает при переходе к температуре стеклования.
3. Продолжая охлаждение, мы перейдём в состояние, при котором процессы структурной перестройки становятся настолько малыми, что ими можно пренебречь. При температурах ниже температуры стеклования структура остается неизменной при любых скоростях охлаждения стекла. В этом случае вещество переходит в термодинамически неравновесное, но кинетически устойчивое состояние.