Глава 1
ФИЗИКО-ХИМИЧЕСКОЕ СТРОЕНИЕ МАТЕРИАЛОВ
СТРОЕНИЕ АТОМА И ХИМИЧЕСКАЯ СВЯЗЬ В ВЕЩЕСТВАХ
Исходя из постулата о том, что в атоме разрешенными для электронов орбитами являются только те, на длине которых укладывается целое число длин волн де Бройля λ, определить радиус стационарной орбиты и соответствующий ей энергетический уровень электрона для невозбужденного состояния атома водорода.
Решение
При движении электрона по стационарной орбите радиусом r центробежная сила уравновешивается силой кулоновского притяжения:
 (1.1)
(1.1)
где  кг — масса электрона;
кг — масса электрона;  — скорость движения электрона по орбите;
— скорость движения электрона по орбите;  Кл — заряд электрона;
Кл — заряд электрона;  Ф/м — электрическая постоянная.
Ф/м — электрическая постоянная.
В соответствии с постулатом
 , (1.2)
, (1.2)
где  ;
; 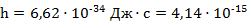 эВ·с — постоянная Планка.
эВ·с — постоянная Планка.
Возводя в квадрат обе части уравнения (1.2), получаем
 (1-3)
(1-3)
Подстановка (1.3) в (1.1) дает
 (1.4)
(1.4)
Полная энергия электрона в атоме складывается из кинетической энергии движения по орбите и потенциальной энергии притяжения к ядру. Полагая, что потенциальная энергия равна нулю при бесконечном удалении от ядра, можем записать
 .
.
С учетом (1.1) имеем
 (1.5)
(1.5)
т. е. полная энергия электрона равна половине потенциальной. Подстановка (1.4) в (1.5) дает следующее выражение для энергии электрона в атоме:
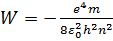 .
.
Для невозбужденного состояния атома водорода п=1. Тогда имеем
 ;
;
 .
.
1.1.2. Определить длину волны излучения атома водорода при переходе электрона с энергетического уровня с главным квантовым числом  в основное состояние (
в основное состояние (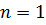 ).
).
1.1.3. В приближении боровской модели атома водорода определите частоту кругового движения электрона по орбите для невозбужденного состояния атома.
1.1.4. Укажите распределение электронов по квантовым состояниям в свободных атомах кремния и меди. Какие электроны участвуют в химической связи, если эти вещества находятся в кристаллическом состоянии? Объясните различия в природе химической связи.
1.1.5. В молекуле воды угол связи  составляет
составляет  , а расстояние между ионами кислорода и водорода равно
, а расстояние между ионами кислорода и водорода равно  нм. Вычислить электрический дипольный момент молекулы воды, предполагая связь атомов
нм. Вычислить электрический дипольный момент молекулы воды, предполагая связь атомов  ионной, и сравните его с моментом
ионной, и сравните его с моментом  Кл·м, измеренным опытным путем. Чем вызвано несовпадение значений вычисленного и экспериментального моментов?
Кл·м, измеренным опытным путем. Чем вызвано несовпадение значений вычисленного и экспериментального моментов?
1.1.6. Электрический дипольный момент частицы вещества (атома, иона, молекулы, группы ионов) в системе СГС выражают в дебаях ( СГС-единицы дипольного момента). При тех же условиях, что и в предыдущей задаче, определите электрический момент (в дебаях) пары
СГС-единицы дипольного момента). При тех же условиях, что и в предыдущей задаче, определите электрический момент (в дебаях) пары  в молекуле воды.
в молекуле воды.
1.1.7. Каждая связь  в алмазе имеет энергию
в алмазе имеет энергию  эВ. Сколько энергии необходимо затратить для испарения
эВ. Сколько энергии необходимо затратить для испарения  г алмаза?
г алмаза?
Решение
Число атомов, содержащихся в объеме вещества массой т,
 ,
,
где  — число Авогадро;
— число Авогадро; 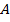 — атомная (или молярная) масса.
— атомная (или молярная) масса.
Для алмаза массой  г
г
 .
.
Каждый атом углерода в структуре алмаза участвует в четырех ковалентных связях, поэтому число связей вдвое превышает число атомов. Энергия, необходимая для испарения  г алмаза,
г алмаза,

1.1.8. Какие из перечисленных молекул являются полярными:  ,
,  ,
,  ,
, 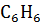 ,
,  ? Приведите другие примеры полярных и неполярных молекул.
? Приведите другие примеры полярных и неполярных молекул.
1.1.9*. Изобразите (качественно) зависимость энергии взаимодействия атомов водорода от межъядерного расстояния при различных ориентациях спинов электронов во взаимодействующих атомах. Каково при этом распределение электронной плотности между атомами?
1.1.10*. Определить, какой из двух пар атомов:  и
и  или
или  и
и  — характеризуется большей разностью электроотрицательностей?
— характеризуется большей разностью электроотрицательностей?
1.1.11*. В спектре испускания атома водорода есть линия, соответствующая длине волны  мкм. Определить изменение энергии атома водорода при излучении, соответствующем данной спектральной линии.
мкм. Определить изменение энергии атома водорода при излучении, соответствующем данной спектральной линии.
СТРОЕНИЕ ТВЕРДЫХ ТЕЛ
1.2.1*. Исходя из постулата Магнуса о том, что у ионных бинарных соединений устойчивой является лишь такая кристаллическая решетка, в которой меньший по размеру катион окружен более крупными анионами, найдите отношения радиусов ионов противоположного знака  , при которых возможно образование устойчивых структур с координационными числами 4, 6, 8 и 12.
, при которых возможно образование устойчивых структур с координационными числами 4, 6, 8 и 12.
Решение
Если координационное число равно четырем, то анионы располагаются по вершинам правильного тетраэдра, а катион — в его центре (рис. 1). Длина отрезка  , соединяющего вершину с центром тетраэдра, связана с длиной а ребра соотношением
, соединяющего вершину с центром тетраэдра, связана с длиной а ребра соотношением  . В предельном случае для данной координации выполняются равенства:
. В предельном случае для данной координации выполняются равенства:  ,
,  Отсюда имеем
Отсюда имеем

Рис. 1
 .
.
При отношении ионных радиусов  структура с координационным числом 4 становится неустойчивой, так как отталкивание анионов друг от друга сильнее их кулоновского притяжения к положительно заряженному иону.
структура с координационным числом 4 становится неустойчивой, так как отталкивание анионов друг от друга сильнее их кулоновского притяжения к положительно заряженному иону.
Если координационное число равно шести (рис. 2, а) или восьми (рис. 3, а), то предельные отношения радиусов ионов можно найти из рис. 2, б и 3, б. При октаэдрическом окружении катиона (рис. 2, б)  ), откуда
), откуда 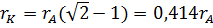 .
.

Рис. 2.
Если координационное число равно восьми, то анионы располагаются по вершинам куба (рис. 3, б) и выполняются соотношения:
 .
.
откуда следует, что
 .
.

Рис. 3.
Координационное число, равное 12, реализуется лишь в структурах с плотной кубической (рис. 4) или плотной гексагональной упаковкой шаров ионов. В этом случае
 .
.
откуда получаем, что  .
.
На рис. 4 позиции анионов первой координационной сферы показаны светлыми кружочками.

Рис. 4.
Кулоновское взаимодействие между ионами является ненаправленным и ненасыщенным. Ненасыщенность ионной связи проявляется в том, что каждый ион стремится приблизить к себе как можно больше противоположно заряженных ионов, т. е. образовать структуру с возможно более высоким координационным числом. Поэтому координационное число растет с увеличением размера катиона. Пределы изменения отношения радиусов ионов для структур с различным координационным числом приведены в табл. 1.
Таблица 1
| Координационное число | ||||

| 
| 
| 
| 1,0 |
1.2.2*. Покажите, что кристаллическая решетка типа алмаза эквивалентна двум взаимопроникающим гранецентрированным кубическим решеткам.
1.2.3*. Радиусы ионов  и
и  равны соответственно
равны соответственно  и
и  нм. Определите, может ли соединение
нм. Определите, может ли соединение  кристаллизоваться в структуре хлористого натрия.
кристаллизоваться в структуре хлористого натрия.
1.2.4. Приведите примеры металлов, кристаллическая структура которых характеризуется плотной кубической упаковкой ионов-шаров.
1.2.5. Определить, сколько атомов приходится на одну элементарную ячейку в кристаллах с простой, объемно-центрированной и гранецентрированной кубической решеткой.
1.2.6. Гранецентрированная кубическая решетка состоит из атомов одного вида, имеет шесть атомов в центрах граней и, кроме того, восемь атомов в вершинах куба. Доказать, что объем, занимаемый атомами ячейки, составляет  объема куба.
объема куба.
1.2.7*. Определить углы между следующими кристаллографическими направлениями в кубическом кристалле: а)  и
и  ; б)
; б) 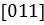 и
и  ; в)
; в) 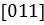 и
и  .
.
1.2.8. В кубической кристаллической решетке постройте плоскости с индексами Миллера 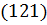 и
и  .
.
1.2.9. В систему  кубического кристалла входят плоскости
кубического кристалла входят плоскости  ,
,  ,
, 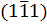 ,
,  ,
,  ,
,  ,
,  и
и 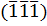 . Какие из этих плоскостей параллельны? Какую пространственную фигуру образуют все эти плоскости при взаимном пересечении?
. Какие из этих плоскостей параллельны? Какую пространственную фигуру образуют все эти плоскости при взаимном пересечении?
1.2.10. Определить расстояние между ближайшими параллельными плоскостями  в кубической кристаллической решетке с периодом а элементарной ячейки.
в кубической кристаллической решетке с периодом а элементарной ячейки.
1.2.11*. Вычислить, сколько атомов располагается на  плоскостей
плоскостей  и
и  в кристаллической решетке кремния, если межатомное расстояние
в кристаллической решетке кремния, если межатомное расстояние  нм.
нм.
Решение
Кремний кристаллизуется в решетке алмаза, где межатомное расстояние  равно
равно  большой диагонали куба. Поэтому период решетки
большой диагонали куба. Поэтому период решетки  м.
м.
Из рис. 5 следует, что на плоскости  элементарной ячейки находится два атома кремния (поскольку каждый угловой атом одновременно принадлежит четырем соседним ячейкам):
элементарной ячейки находится два атома кремния (поскольку каждый угловой атом одновременно принадлежит четырем соседним ячейкам): 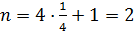 . Отсюда поверхностная плотность атомов
. Отсюда поверхностная плотность атомов
 .
.
На рис. 6 показано расположение атомов на плоскости  . Равностороннему треугольнику площадью
. Равностороннему треугольнику площадью  принадлежит в среднем два атома:
принадлежит в среднем два атома:  . Поверхностная плотность атомов в этой плоскости
. Поверхностная плотность атомов в этой плоскости

 .
.
 Рис. 5
Рис. 5
| 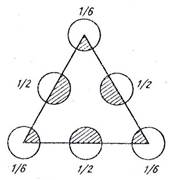 Рис. 6
Рис. 6
|
1.2.12*. Приведите примеры полиморфных превращений для элементных веществ и химических соединений. Охарактеризуйте различие свойств политипов.
1.2.13*. Вычислите относительное изменение объема материала при переходе железа из гранецентрированной в объемно-центрированную кубическую решетку, если межатомные расстояния в этих структурах соответственно равны  и
и  нм.
нм.
1.2.14*. Ион хлора имеет радиус  нм. Каков радиус наименьшего одновалентного положительного иона, который может соседствовать с восемью ионами хлора? Приведите пример щелочно-галоидного соединения, структура которого имеет подобную координацию ионов.
нм. Каков радиус наименьшего одновалентного положительного иона, который может соседствовать с восемью ионами хлора? Приведите пример щелочно-галоидного соединения, структура которого имеет подобную координацию ионов.
1.2.15*. Докажите, что направление  в кубической кристаллической решетке нормально плоскости
в кубической кристаллической решетке нормально плоскости  .
.
Решение
В кубической кристаллической решетке координатные оси ортогональны, причем масштабные коэффициенты по всем трем осям одинаковы. Поэтому плоскость  отсекает на координатных осях отрезки в пропорции
отсекает на координатных осях отрезки в пропорции  . На рис. 7 направлению
. На рис. 7 направлению  соответствует вектор
соответствует вектор  . Для решения задачи достаточно доказать, что вектор
. Для решения задачи достаточно доказать, что вектор  перпендикулярен отрезкам
перпендикулярен отрезкам  и
и  , являющимся следами плоскости
, являющимся следами плоскости  .
.
Пусть  — проекция вектора
— проекция вектора  на плоскость
на плоскость  . Легко убедиться, что треугольники
. Легко убедиться, что треугольники  и
и  подобны. Поэтому отрезок
подобны. Поэтому отрезок  нормален плоскости
нормален плоскости  , а значит, и вектору
, а значит, и вектору  . Аналогично можно показать, что
. Аналогично можно показать, что  и
и  также взаимно перпендикулярны. Отсюда следует, что вектор
также взаимно перпендикулярны. Отсюда следует, что вектор  является нормалью к плоскости
является нормалью к плоскости  .
.

Рис.7
1.2.16*. Укажите кристаллографические направления в ромбической решетке с размерами элементарной ячейки  нм;
нм;  нм;
нм;  нм:
нм:  ,
, 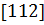 ,
, 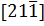 .
.
1.2.17. Известно, что алюминий кристаллизуется в решетке гранецентрированного куба с периодом идентичности  нм. Вычислите концентрацию свободных электронов, полагая, что на каждый атом кристаллической решетки приходятся три электрона.
нм. Вычислите концентрацию свободных электронов, полагая, что на каждый атом кристаллической решетки приходятся три электрона.
Решение
В решетке гранецентрированного куба на одну элементарную ячейку приходится четыре атома. Поэтому число атомов в единице объема
 .
.
Отсюда концентрация электронов
 .
.
1.2.18. Вычислите период кристаллической решетки меди, если ее плотность равна  , а элементарная ячейка представляет собой гранецентрированный куб. Определите объем, приходящийся на один атом.
, а элементарная ячейка представляет собой гранецентрированный куб. Определите объем, приходящийся на один атом.
Решение
Рентгеновская плотность кристалла связана с периодом кубической решетки соотношением  , где
, где  — масса атома;
— масса атома;  — число атомов, приходящихся на одну элементарную ячейку (кратность ячейки). В случае гранецентрированного куба
— число атомов, приходящихся на одну элементарную ячейку (кратность ячейки). В случае гранецентрированного куба  . Учитывая, что
. Учитывая, что  (см. решение задачи 1.1.7), получаем
(см. решение задачи 1.1.7), получаем
 м
м
На один атом решетки приходится объем
 .
.
1.2.19. Расстояние между ближайшими атомами в кристаллической решетке вольфрама равно  нм. Известно, что вольфрам имеет структуру объемно-центрированного куба. Найдите плотность материала.
нм. Известно, что вольфрам имеет структуру объемно-центрированного куба. Найдите плотность материала.
1.2.20. Определите концентрацию свободных электронов в натрии, элементарная ячейка которого представляет собой объемно-центрированный куб с ребром  нм.
нм.
1.2.21. В чем состоят различия между монокристаллами, поликристаллическими и аморфными веществами?
1.2.22. Приведите примеры точечных и протяженных дефектов структуры реальных кристаллов.
1.2.23*. Определите ковалентный тетраэдрический радиус атома кремния, если известно, что кремний кристаллизуется в структуре алмаза с периодом решетки 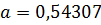 нм.
нм.