Физические свойства воды
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н2О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь:  . Между молекулами воды существует межмолекулярная водородная связь: Н2O ··· Н2O.
. Между молекулами воды существует межмолекулярная водородная связь: Н2O ··· Н2O.
Химические свойства воды
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н2O. С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н2O = 2LiOH + Н2↑,
Са + 2Н2O = Са(ОН)2 + Н2↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н2O = ZnO + Н2↑,
3Fe + 4Н2O = Fe3O4 + 4Н2↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи:
Na2O + Н2O = 2NaOH,
СаО + Н2O = Са(ОН)2.
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты:
СO2 + Н2O = Н2СO3,
SO3 + Н2O = H2SO4.
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К2СO3 + Н2O = КНСО3 + КОН,
РСl3 + ЗН2O = Н3РО3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C2H5OH — реакция этилена С2Н4 с водой:
С2Н4 + Н2O = С2Н5ОН.
Жесткость воды — это свойства воды, обусловленные содержанием в ней ионов Са2+, Mg2+, Fe2+. Если концентрация этих ионов велика, то воду называют жесткой, если мала — мягкой. При стирке с мылом в жесткой воде образуются осадки, часть мыла уходит в осадок и ухудшается качество ткани. Такая вода непригодна для охлаждения в радиаторах автомобилей, в паровых котлах и стиральных машинах. При нагревании жесткой воды образуется накипь, которая забивает трубы и ускоряет изнашивание механизмов. Различают временную и постоянную жесткость воды.
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО3)2, магния Mg(HCO3)2 и железа Fe(HCO3)2. При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO3)2 = СаСО3↓ + СO2↓ + Н2O,
Fe(HCO3)2 = FeCO3↓ + CO2↓ + Н2O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
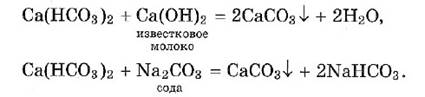
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl2 + Na2CO3 = СаСO3↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.