адекватный калорический баланс, сохранение запасов жира при потере мышечного и висцерального пулов белка.
Смешанный тип
Обычно результатом ограничения приёма пищи при дисфагии, существующего в течение длительного времени и ведущего к потере подкожного жира и мышечной массы, становится дефицит калорий и соматического пула белка, но с сохранением висцерального пула (маразматический тип, Фото 3).

Фото 3. Маразматический тип недостаточности питания (собственное наблюдение).
При неадекватно низком потреблении белка с пищей и нормальном калорическом балансе развивается истощение квашиоркор (Фото 10). При этом в организме больного сохраняются запасы жира, но потеря обоих пулов белка обусловливает развитие отёков. Для ситуации острого метаболического стресса (травмы, хирургические операции, тяжёлые инфекционные процессы) характерен именно квашиоркор. Отягощение течения нейрогенной дисфагии с маразматическим типом алиментарной дистрофии острым инфекционным процессом является причиной смешанного типа недостаточности питания (присоединение пневмонии, например, при амиотрофическом боковом склерозе). Нарушения питания, снижая иммунореактивность неврологических больных, способствуют обострениям хронического воспалительного процесса в лёгких, развитию острых синуситов и отитов, образованию пролежней, увеличению длительности пребывания в стационаре и росту летальности [Ч.П. Ворлоу с соавт., 1998]. Нарушение глотания, возникшее при инсульте, приводя к респираторным осложнениям и недостаточности питания, является основной причиной смертности [Veis & Logemann, 1985; Horneretal., 1988]. Восстановление функции глотания при инсульте обусловливает улучшение нутриционных параметров и нормализацию трофологического статуса [Gariballaetal., 1998].
Общение за столом является важнейшим атрибутом повседневной жизни современного человека. Без него немыслимо проведение, как досуга, так и деловых мероприятий. Дисфагия драматично влияет на качество жизни неврологических больных. Она превращает удовольствие от еды в переживание и мучение. Она делает пациентов зависимыми при кормлении от других людей или от искусственного питания. Она может принять вид постоянной угрозы неожиданной обструкции воздушных путей или респираторных инфекций от аспирации. Дисфагия приводит к изменению психического состояния, депрессии и социальной дезадаптации.
Диагностика причины и уровня расстройства акта глотания при заболеваниях нервной системы с определением терапевтической тактики сложный и многоступенчатый процесс. Условно в нём можно было бы выделить четыре основных этапа. Первой задачей при осмотре «дисфагичных» больных является исключение потенциальных не нейрогенных причин дисфункции глотания. Затем надлежит понять индивидуальный механизм дисфагии конкретного больного, используя «прикроватную оценку» и результаты дополнительных методов исследования, и определить специфическую стратегию безопасного и эффективного приёма пищи через рот или необходимость протезирования акта глотания. Следующее: очень важно предупредить или не пропустить признаки возможных осложнений нарушенного глотания. А уже потом на основании объективных данных осмотров и инструментальных обследований, продумать программу лечебных и реабилитационных мероприятий.
Анамнез может обеспечить постановку правильного диагноза более чем у 80% больных [Schatzki, 1959]. Главные вопросы, которые следует выяснить у больного и его родственников:
· «Какой вид пищи вызывает проблемы?»;
· «В какой момент глотания возникают трудности?»;
· «Есть ли изжога?»;
· «Дисфункция глотания прогрессирует, стабильна или по какой-то причине вариабельна?»;
· «Есть ли ещё какие-то заболевания, течение которых может сопровождаться дисфагией (коллагенозы, опухоли и т.д.)?»;
· «Проводились ли какие-либо хирургические вмешательства в тех областях, где располагаются структуры, обеспечивающие акт глотания (голова, шея, грудная клетка)?»;
· «Изменился ли голос?»;
· «Есть ли кашель или удушье во время еды?»;
· «Изменился ли сон (храп, кашель)?;
· «Нет ли температуры, ознобов, ночных потов?»;
· «Как больной приспосабливается к нарушениям глотания?».
· «Является ли дисфагия источником изоляции и депрессии?»;
Очень важную информацию даёт знание о консистенции пищи, приводящей к дисфагии. Нейрогенную (орофарингеальную) дисфагию вызывают, как правило, жидкие болюсы. Затруднения, возникающие при употреблении только твёрдой пищи, указывают на наличие механической дисфагии. При дальнейшем уменьшении просвета застрявший пищевой комок уже нельзя протолкнуть через суженный участок выпитой вслед жидкостью. При ахалазии и диффузном спазме пищевода к дисфагии с самого начала заболевания одинаково приводит употребление как твёрдой, так и жидкой пищи. Натуживание, выпивание залпом нескольких стаканов жидкости, сублингвальный приём нитроглицерина облегчают ахалазию кардии, что воспринимается больными как "провал пищи в желудок" [В. Нечаев и А. Трухманов,1992]. Склеродермия, характеризуется затруднением пассажа в желудок твёрдой пищи вне зависимости от положения тела и жидкости в положении лёжа, и изжогой, вследствие развития желудочно-пищеводного рефлюкса и эзофагита. В результате прогрессирующего при склеродермии патологического изменения стенок пищевода образуется стриктура, и дисфагия становится стойкой. При выраженном рефлюксе страдают глотка и слизистая оболочка полости рта, может быть ларингит, дисфония (охриплость) по утрам и лёгочная аспирация, чреватая пневмонией, фиброзом лёгких или хроническими приступами астмы [Р.К. Гойял, 1996]. Дисфункция глотания (проблемы с жеванием, формированием пищевого комка и началом глотания), возникающая перед глотком свидетельствует о нарушении ротовой фазы, сразу же после глотания (регургитация пищи в нос, кашель, удушье) – глоточной, а дисфагия через несколько секунд после глотка (ощущение препятствия прохождению пищи за грудиной) – пищеводной [Schulze-Delrieu & Miller, 1997]. Если хрипота предшествует дисфагии, то первичное поражение обычно локализуется в гортани. Появление хрипоты вслед дисфагии указывает на вовлечение возвратного гортанного нерва при распространении рака пищевода. Сочетание симптомов поражения гортани с дисфагией наблюдается при различных нервно-мышечных нарушениях. Для них характерно также медленное прогрессирование и пожизненное существование дисфагии (мышечная дистрофия, амиотрофический боковой склероз и т.д.), либо острое её появление после какого-то события (инсульт, операция на голове или шее и т.д.) [Schulze-Delrieu & Miller]. Быстро прогрессирующая в течение нескольких месяцев дисфагия и/или выраженное снижение массы тела, не пропорциональное тяжести дисфагии, заставляют думать о раке пищевода. Непродолжительная преходящая дисфагия может быть обусловлена каким-либо воспалительным процессом. При пищеводной дисфагии обычны жалобы на «зависание» пищи за грудиной: локализация дисфагии обычно коррелирует с местом обструкции пищевода. Однако восприятие больными локализация дисфагии в области шеи, как правило, не имеет диагностической ценности, поскольку эти ощущения возможны при поражении глотки, шейного отдела и даже более низко расположенных участков пищевода. Бульканье при прохождении воздуха через глотку, наполненную слизью, характерно для параличей глотки и гортани. Поэтому даже у больных, находящихся в бессознательном состоянии, они довольно легко распознаются [Л.М. Попова, 1983]. Регургитация в нос и трахеобронхиальная аспирация при глотании являются признаками паралича мышц глотки или наличия трахеопищеводного свища. Трахеобронхиальная аспирация, не связанная с глотанием, может быть вторичной при ахалазии, дивертикуле Ценкера или желудочно-пищеводном рефлюксе. Боль при глотании (одинофагия) указывает на острый или хронический воспалительный процесс в глотке или пищеводе. Боль в области грудной клетки, сочетающаяся с дисфагией, развивается при диффузном спазме пищевода и связанных с ним двигательных нарушениях. При патологии дистального отдела пищевода могут быть жалобы на икоту. Больные пытаются приспосабливаться и компенсировать возникшие проблемы с глотанием, меняя консистенцию и температуру пищи, запрокидывая голову или помогая пальцами продвинуть еду к зеву, наклоняя или поворачивая голову, надавливая на одну сторону шеи, подпрыгивая после глотка. Из-за того, что приём пищи сопряжён с болью, кашлем и т.д., больные тревожатся и смущаются, воздерживаются от еды в присутствии других людей, впадают в депрессию, становятся равнодушными к еде. Иногда жалобы, напоминающие симптомы нейрогенной дисфагии, на самом деле имеют психогенную основу [Buchholzetal., 1994]. Их выраженность может драматично колебаться, и возникают они, как правило, у относительно молодых людей, у которых нет дисфонии или какого-либо другого объективного неврологического дефицита. Больные с психогенной дисфагией утверждают, что не способны есть и пить, делают это с неохотой, долго перемещают болюс во рту и, даже когда разоблачается (например, при видеорентгеноскопии) их способность глотать успешно, продолжают жаловаться на затруднения глотания. Однако важность тщательного поиска альтернативного диагноза, даже при отсутствии доказательств неврологического заболевания, не может быть преувеличена. Симптомы, наиболее характерные для нейрогенной дисфагии, представлены в Таблице 5.
Таблица 5. Клинические симптомы, указывающие на нейрогенную дисфагию.
· Трудности в проглатывании жидкости
· Слюнотечение или частое сплёвывание слюны
· Прилипание пищи в горле и/или глотке
· Удушье и кашель при приёме пищи и жидкости, проглатывании слюны
· Ослабление (или отсутствие) произвольного или непроизвольного кашля
· Влажный или булькающий голос
· Дискомфорт в глотке и рецидивирующие бронхолёгочные инфекции
· Носовая регургитация
· Необходимость повторных глотков, чтобы освободить глотку
· Потеря веса, изменение трофологического статуса
Осмотр «дисфагичного» больного должен состоять из неврологической (включая исследование функции тройничных, лицевых, языкоглоточных, блуждающих и подъязычных черепных нервов), психологической, логопедической и отоневрологической оценки (обязательно непрямая ларингоскопия) [Buchhols, 1994], наблюдения больного во время глотания различных видов и объёмов жидкости и пищи, исследования дыхательной системы и анализа трофологического статуса [Detsky, 1987]. Как скрининг-тесты для отбора больных с аспирацией, требующих полной инструментальной оценки дисфагии, используется глотание фиксированных болюсов с разными объёмами (3, 5, 10, 15 и 20 мл) и с определённой вязкостью (жидкость, газированная вода и пудинг) и наблюдение кашля или удушья при питье 50 мл воды [DePippo, 1992]. В Таблице 6 перечислены необходимые «пункты», которые следует включать в схему клинического обследования при нейрогенной дисфагии.
Таблица 6. Клиническое обследование больного с дисфагией
· Когнитивные, речевые и поведенческие особенности
· Инспекция рта (зубы, состояние слизистой оболочки и т.д.)
· Стереотип поведения во время приёма пищи
· (медлительность, застывание и т.п.)
· Функция губ и жевательной мускулатуры, объём движений нижней челюсти
· Вытекание жидкости или пищи изо рта
· Оценка скорости формирования пищевого болюса и проглатывания жидкости
· Функция мягкого нёба и глоточный рефлекс
· Объём движений и сила языка
· Фиксация дополнительных глотательных движений
· Степень очищения ротовой полости после глотка
· Объём движений подъязычной кости
· Голос и его изменения после глотания
· Регистрация попёрхивания, кашля или удушья во время или после глотка
· Аускультация трахеи во время глотка
· Непрямая ларингоскопия (консультация отоневролога)
· Оценка кашлевого толчка
· Перкуссия и аускультация лёгких
· Оценка трофологического статуса и гидратации: кожа и слизистые; вес; диурез; потеря подкожного жира (трицепсы); мышечная атрофия (дельтовидные, четырёхглавые мышцы)
· Исследование шеи (лимфатические узлы, щитовидная железа, позвоночник)
Здесь необходимо специально остановиться на диагностической ценности глоточного (рвотного) рефлекса, который, по мнению многих врачей, является надёжным показателем, даже«индикатором» дисфункции глотания. На самом деле, корреляция между рвотным рефлексом и безопасным глотанием настолько слабая, что нормальный глоточный рефлекс может сосуществовать с тяжёлой нейрогенной дисфагией, тогда как при сохранном глотании у многих здоровых людей он либо отсутствует, либо снижен [Ellul & Barer, 1993; Davies, Kidd, Stone, & MacMahon, 1995; Ч.П. Ворлоу с соавт., 1998].
Клиническую оценку дополняют рентгеноскопия акта глотания с барием; гибкая носовая эндоскопия и глоточно-пищеводная манометрия, позволяющие проанализировать уровень и выраженность поражения, безопасность и эффективность глотания, и утвердится в диагнозе. Кроме того, у больных с дисфагией используются электромиография мышц, участвующих в глотании (надподъязычных, жевательных мышц, языка и др.), ультразвуковая оценка глотания, эзофагогастроскопия, рентгенологическое исследование грудной клетки, компьютерная (или магниторезонансная) томография шеи и органов грудной клетки.
«Глотательный тракт» простирается от губ до кардии, поэтому только рентгенологическое исследование с глотком бария даёт возможность в целом рассмотреть как его анатомическое строение, так и выявить дисфункцию механизмов, обеспечивающих акт глотания, на любой физиологической стадии прохождения болюса. Это особенно полезно в тех случаях, когда непонятно, что главным образом вовлечено в патологический процесс - глотка или пищевод. Поскольку глотание происходит за короткий промежуток времени (особенно его фарингеальная фаза), то во время простого рентгеноскопического исследования невозможно детально проанализировать происходящие события. Поэтому золотым стандартом для изучения (особенно орофарингеальной) дисфагии,считается видеорентгеноскопия. Метод основывается на видеозаписи рентгеноскопической картины проглатывания контрастного болюса (Фото 1, 4). Больной обследуется в боковой и прямой проекциях.
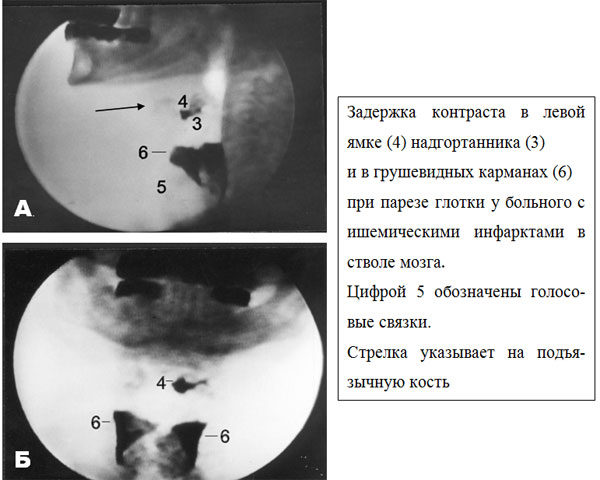
Фото 4. Кадры видеорентгеноскопической записи: А. в боковой и Б. в прямой проекциях (совместное наблюдение с Н.В. Докучаевой).
Начинать рекомендуется с боковой проекции, так как именно такой взгляд на процесс глотания даёт большую часть информации. Осматривается поверхность, ограниченная спереди губами, сзади - задней стенкой глотки, вверху - твёрдым нёбом, внизу - 7-м шейным позвонком (Фото 4 А.). Прямая проекция необходима, так как позволяет диагностировать асимметричность поражения при параличах глотки и гортани, выраженность стаза в валлекулах надгортанника и грушевидных карманах и не пропустить, например, дивертикул. Применяются три консистенции рентгеноконтрастного материала: начинают с жидкого бария, затем дают бариевую пасту и заканчивают исследование кусочком хлеба (или 1/4 домашнего печенья), покрытого бариевой пастой для оценки жевания и адекватности формирования пищевого болюса. Для получения повторяемости результатов больной делает два глотка каждого материала в контролируемых малых количествах (1/3 чайной ложки жидкости и 1/3 чайной ложки пасты). Ограничение количества контраста (так называемый «модифицированный бариевый глоток») при видеорентгеноскопическом исследовании акта глотания предложено Veis & Logemann [1985]. Частота аспирации, например, при инсульте свидетельствует в пользу использования именно модифицированного, а не рутинного, бариевого глотка. Даже если больной аспирирует, только очень маленькое количество контрастного материала попадёт в нижние дыхательные пути. Кроме того, при использовании больших объёмов бария, структуры ротовой полости и глотки частично облитерируются рентгеноконтрастным веществом, что затрудняет интерпретацию двигательных событий [Veis & Logemann, 1985; Logemann, 1997]. Таким образом, модифицированный бариевый глоток облегчает оценку физиологии глотания оральной и фарингеальной фаз с минимальным риском аспирации.Если больной аспирирует, исследование заканчивается, как только причина аспирации определена. Протокол исследования трансформируется в каждом конкретном случае, в зависимости от истории болезни, данных клинического обследования и полученных находок. Для идентификации нарушений глотания и для измерения времени прохождения болюса каждая видеозапись анализируется с обычной скоростью, при замедленном просмотре и кадр за кадром.Видеорентгеноскопический метод с высокой степенью достоверности позволяет сделать заключение, насколько глотание безопасно и эффективно. Понятие «безопасное глотание» означает, что во время еды никакие инородные вещества не проникают в нижние дыхательные пути, а понятие «эффективное глотание» подразумевает, что после глотка во рту, глотке или пищеводе не задерживается никаких остатков пищи [Clave, 2001].
Видеорентгеноскопия выявляет признаки дисфункции на различных этапах акта глотания. Остановимся подробнее на проявлениях орофарингеальной дисфагии, характерной для неврологических больных. В процессе исследования хорошо видны нарушения жевания, обусловленные слабостью или дискоординацией жевательных мышц или смещением нижней челюсти. При этом следует помнить о стоматологических проблемах, которые влияют на способность жевать и формировать пищевой комок. При болезнях Паркинсона или Альцгеймера больным свойственно пожёвывать, а не разжёвывать пищу [Perlman, Lu & Jones, 1997]. Растягивание времени формирования болюса характерно как для больных с деменцией, у которых это может быть формой ротовой или вкусовой агнозии, когда больной не ощущает положение болюса во рту или не производит необходимые движения языком или челюстью, так и для больных с апраксией глотания. В последнем случае больные могут глотать болюс любого объёма и вязкости без его подготовки [Perlman, Lu & Jones, 1997]. Кроме того, ротовая фаза удлиняется из-за ксеростомии, обусловленной гипофункцией слюнных желёз или приёмом препаратов, снижающих слюноотделение. При слабом (вследствие пареза или дискоординации) языке болюс распространяется по всей ротовой полости, заваливается под язык и/или застревает на твёрдом нёбе. Слабость губ усиливает трудности удержания и формирования болюса. Поражение лицевого нерва с параличом щёчных мышц (m.m. buccinators) сопровождается складированием пищи за щеками, о котором больной не подозревает. Слабость губ, языка, щёк приводит к удлинению ротовой фазы при проглатывании твёрдого болюса и её укорочению при глотании жидкости. В последнем случае происходит преждевременное стекание контраста в глотку, характеризующее несостоятельность ротовых структур. В отличие от потери болюса, замедленная инициация глотка (отсроченное время или латентность ответа [Langmore, 2001])обусловлена несвоевременным срабатыванием триггера глотательного рефлекса вследствие гипестезии корня языка и, возможно, глотки и плохого центрального контроля. При видеорентгеноскопии преждевременная потеря болюса проявляется отделением порции несформированного болюса и стеканием его с корня языка, как правило, в валлекулы надгортанника, тогда как при отсроченной инициации глотательного рефлекса болюс формируется и доставляется языком в глотку, а вот глоток своевременно не возбуждается. Считается существенным запаздывание инициации глотка на секунду и более. Удлинение отсрочки повышает вероятность аспирации болюса [Perlmanetal., 1994]. Раскачивание и обилие колебательных движений языка наблюдается у больных с психогенной дисфагией, когда они жалуются на свою неспособность глотать и сопротивляются инициации глотания. В этих случаях видеорентгеноскопическое исследование обнаруживает странное, напряжённое, сложное поведение с оральной или язычной активностью, не продвигающей болюс, но и не сопровождаемое утечкой орального содержимого в глотку. При инициировании глотательного рефлекса (часто отсроченном из-за «ротовой» борьбы) реализуется нормальная фарингеальная фаза [Barofskyetal., 1994]. В отличие от психогенного беспокойства языка миоклония проявляется быстрыми непроизвольными повторяющимися подёргиваниями мышц вовлечённых структур, как в покое, так и при движениях. Ориентиром начала фарингеальной фазы является поднятие подъязычной кости. Именно это движение имеет решающее значение в перемещении гортани вверх и вперёд. В норме подъязычная кость двигается в среднем на 9-12 мм вперёд и на 11-12 мм вверх. [Jacobetal., 1989]. Ограничение подвижности подъязычной кости увеличивает риск аспирации в 3,7 раза [Perlmanetal., 1994]. Слабость надподъязычных мышц ведёт к малоподвижности надгортанника и скоплению контраста в его валлекулах (Фото 1,4). Остатку также способствует уменьшение давления на надгортанник корнем языка. Если умеренный стаз в валлекулах в два раза увеличивает вероятность аспирации, то дальнейшее накопление создаёт ещё большую угрозу попадания инородных веществ в нижние дыхательные пути [Perlmanetal., 1994]. При видеорентгеноскопии хорошо визуализируется первый этап двигательного фарингеального паттерна: разделение носоглотки и ротоглотки. При несостоятельности «нёбно-глоточного затвора» (слабость мягкого нёба или верхнего констриктора глотки, или несогласованность их сокращений с преждевременным открытием или отсроченным закрытием «затвора») регистрируется носовая регургитация. Но при задержке болюса в глотке даже адекватное и достаточное по времени разделение носовой и ротовой частей глотки бывает неэффективно, так как в этих условиях болюс направляется ретроградно и попадает в нос. Зияние полости глотки во время акта глотания и задержка болюса на стенках, в гортанной части или грушевидных карманах свидетельствуют о фарингеальном парезе или параличе. Болюс скапливается в грушевидных карманах не только из-за слабости, но и при нескоординированном сокращении констрикторов глотки и преждевременном закрытии верхнего пищеводного сфинктера. Кроме того, причинами плохого очищения грушевидных карманов являются повышенный тонус крикофарингеальной мышцы, обусловливающий нераскрытие верхнего пищеводного сфинктера, так называемое «крикофарингеальное препятствие (или засов)» (Фото 5), и ограничение подъёма «подъязычно-гортанного комплекса». Рентгенологически крикофарингеальный спазм выглядит как гладкий выступ при входе в пищевод [Murray, Rao & Schulze-Delrieu, 1997]. Но видеорентгеноскопия не даёт возможности судить о спазме или степени релаксации крикофарингеальной мышцы, поэтому термин «крикофарингеальная ахалазия» является прерогативой манометрического исследования [Perlman, Lu & Jones, 1997]. Повторяющиеся неудачные открытия верхнего пищеводного сфинктера при врождённой слабости задней стенки глотки ведут к выпячиванию глоточной слизистой на уровне перехода глотки в пищевод - дивертикулу Ценкера (Zenker’s diverticulum), хорошо заметному при видеорентгеноскопическом исследовании с контрастом[Murray, Rao & Schulze-Delrieu, 1997]. Дивертикул обычно выдавливается между волокнами крикофарингеальной мышцы и нижним констриктором глотки. Эти выпячивания обычно возникают на левой стороне, реже по средней линии на задней стенке и очень редко на правой стороне. Если эти явления резко усиливаются и возникают каждый раз при приёме пищи, может наступить сдавление пищевода, что сопровождается его полной непроходимостью.

Фото 5. Нераскрытие верхнего пищеводного сфинктера: «крикофарингеальный засов» у больного с множественными ишемическими очагами в стволе головного мозга и правом полушарии мозжечка (совместное наблюдение с Н.В. Докучаевой)
Проблемы с формированием компактного болюса, слабость глоточной мускулатуры, неадекватность открытия верхнего пищеводного сфинктера могут выражаться серией дополнительных и маленьких по объёму глотков [Rubesin, 1995; Bakheit, 2001]. Но глотание порциями наблюдается также у больных, которые испытывают ощущения застрявшей пищи во рту или глотке и, таким образом, пытаются их очистить, либо у больных, которые боятся попадания пищи в дыхательные пути при глотании целого болюса и связанного с этим кашля или удушья [Perlman, Lu & Jones, 1997]. Видеорентгеноскопия в прямой проекции с определёнными ограничениями позволяет наблюдать смыкание голосовых складок или отсутствие движений парализованной складки при протяжном произнесении больным звука «и» (но лучше оценивать эту функцию при непрямой и прямой ларингоскопии). Трахеостомические трубки и питающие зонды можно оставлять на месте во время исследования [Logemann, 1997]. Однако, если это допустимо, следует спускать манжету трахеостомической трубки. Надутая манжета может ограничивать поднятие гортани и крикофарингеальное открытие во время глотка. С нашей точки зрения, назогастральный зонд также искажает информацию о процессе глотания. Анализ видеорентгеноскопических данных позволяет диагностировать аспирацию и определить её причину, решить можно ли кормить больного через рот и обосновать лечебные и реабилитационные мероприятия (например, адекватные и безопасные объёмы и вязкость пищи, компенсирующие позы) [Veis & Logemann, 1985; Chen et al., 1990; Logemann, 1995, 1997]. Ненормальная функция пищевода, как правило, описывается либо как сокращение частоты перистальтических волн в ответ на глоток, либо как прерывание перистальтической волны, либо как полное отсутствие перистальтики.

Фото 6. Расширенный «стеклянный» пищевод при склеродермии (совместное наблюдение с Н.В. Докучаевой).
Задержка контраста в расширенном пищеводе, трансформация вида дистального отдела в «клюв птицы» [Perlman, Lu & Jones, 1997] или «мышиный хвост» [А.З. Моргенштерн, 1968] с сохранением нормальных продольных складок слизистой, перемежающееся механическое (под давлением столба скопившейся пищи или контраста) раскрытие пищеводно-желудочного перехода и отсутствие газового пузыря желудка – является рентгенологической характеристикой ахалазии. Проглатывание бария при диффузном спазме пищевода выявляет смену перистальтической волны ниже дуги аорты нескоординированными одновременными его сокращениями и образование множественных складок стенки («штопорообразный» пищевод) или мешотчатых образований («псевдодивертикулярный спазм») при нормально функционирующем нижнем сфинктере пищевода [А.З. Моргенштерн, 1968]. При склеродермии прогрессирующая атрофия и фиброз гладкомышечной части пищевода приводят к истончению стенки («стеклянный пищевод») и исчезновению перистальтической волны в этой области (Фото 6) и зиянию нижнего сфинктера с гастроэзофагеальным рефлюксом [Р.К. Гойал, 1996]. Видеорентгеноскопическое исследование акта глотания, будучи неинвазивным, во многих случаях должно быть первоначальным методом изучения нейрогенной дисфагии. Для инсультных больных оценка может быть назначена, если они в сознании и бодрствуют, через 4-7 дней от начала заболевания [Logemann, 1997]. Однако, по мнению Ч. Ворлоу с соавт. [1998], видеорентгеноскопия имеет определённые ограничения: 1) недостаточную доступность, особенно в острой ситуации; 2) недостаточную доказательность клинической значимости аспирации, обнаруживаемой этим методом; 3) исследование больных в непривычных и искусственно созданных условиях, которые могут влиять на глотание и ограничивать общую значимость результатов; 4) облучение больных; 5) использование рентгеноконтрастного вещества, которое может вызвать повреждение лёгких. С нашей точки зрения, второй пункт является дискуссионным (выявление «немой» аспирации бесценно), а третий пункт – справедлив и для эндоскопического, и для манометрического методов обследования акта глотания.
В 1988 году впервые было сообщено об использовании гибкой носовой эндоскопии для оценки процесса глотания (FEES=FiberopticEndoscopicEvaluationofSwallowing) [Langmore, 2001]. Вскоре появилась другая методика, названная видеоэндоскопической оценкой дисфагии (VEED= videoendoscopicevaluationofdysphagia) и подразумевающая запись обследования на видеомагнитофон [Bastian, 1991]. А в 1992 году английскими отоларингологами была описана «молочная носовая эндоскопия» (“milknaseendoscopy”), как методика, расширяющая видеоэндоскопическую оценку глотания и превышающая идентификацию только аспирации [Wilsonetal., 1992]. Суть гибкой носовой эндоскопии заключается в следующем. После местной анестезии эндоскоп проводится по нижнему носовому ходу в носоглотку, а затем в ротоглотку, и его дистальный конец устанавливается на уровне язычка мягкого нёба (Фото 7 А.). Оцениваются анатомические структуры, состояние и чувствительность слизистой; характер и качество содержимого глотки (включая валлекулы надгортанника и грушевидные карманы); положение корня языка и надгортанника; состояние гортани при дыхании, фонации и кашле. Затем исследуется гортань и глотка в процессе глотания различных по консистенции видов пищевых болюсов объёмом 5 мл.

Фото 7. Гибкая носовая эндоскопия (А) у больного с ишемическими инфарктами в стволе и (Б) ретроградная ларингоскопия (совместное наблюдение с И.М. Кузнецовой и В.В. Селивановым).
Обозначения: 1 –задержка болюса в левой валлекуле надгортанника; 2 - надгортанник; 3 – голосовая щель; 4 – скопление болюса в левом грушевидном кармане; 5 – задержка болюса на правой стенке глотки. Стрелка указывает на аспирацию.
У канюленосителей целесообразно дополнительно проводить обратную ларингоскопию ( Фото 7 Б.) [А.С. Горячев, 1998; И.М. Кузнецова, И.А. Авдюнина и В.В. Селиванов, 2002], позволяющую 100% опознавать аспирацию слюны и пищи. В этом случае гибкий эндоскоп вводится через трахеостомическое отверстие в подсвязочное пространство гортани. В настоящее время для оценки акта глотания гибкая носовая эндоскопия используется наряду с видеорентгеноскопией. Она не является заменой видеорентгеноскопического метода, она расширяет и совершенствует возможности оценки больных с дисфагией и подбора адекватных лечебных мероприятий. Рентгеноскопическое исследование даёт более глобальный взгляд на ротовые, глоточные и пищеводные структуры и позволяет наблюдать за происходящим в ротовой полости, за «поведением» подъязычной кости и гортани и дальнейшим путешествием болюса через глотку, крикофарингеальный жом и пищевод. Эндоскопическая оценка обеспечивает возможность детально рассмотреть глотку и гортань: оценить закрытие дыхательных путей при инициации глотка или для терапевтического манёвра, точно локализовать задержку материала после глотка, сопоставить анатомию с дисфункцией глотания, обозревать события в течение продолжительного периода времени. Нарушение инициации глотательного рефлекса– это отличительный знак неврологических болезней [Veis & Logeman, 1985; Langmore, 2001]. Определить уровень «нервной поломки» механизма доставки информации от чувствительных рецепторов рта, глотки и гортани до корковых центров и обратно с реализацией двигательных ответов чаще всего невозможно. Существенный вклад в этом случае может внести именно эндоскопическое исследование глотания, идентифицируя или исключая потерю периферической чувствительности [Langmore, 2001]. Хотя оба исследования могут быть использованы для выработки безопасной диеты и рекомендаций различных позиционных и глотательных манёвров, гибкая эндоскопия привлекательна для контроля лечения ещё и как инструмент биообратной связи. В тех случаях, когда пациенты находятся в отделении интенсивной терапии (подключены к монитору, респиратору, с множеством трубок), с нарушениями сознания, парализованы и прикованы к постели, имеют контрактуры и пролежни, испытывают боль, когда исследование глотания требуется срочно или повторно (для коррекции диеты), предпочтение отдаётся эндоскопической оценке акта глотания [Langmore & МcCulloch, 1997]. Ни одна диагностическая методика не свободна от риска осложнений. При эндоскопическом исследовании процесса глотания, естественно, больные испытывают дискомфорт от пребывания инородного тела в носу и использования местной анестезии, возможны местные аллергические реакции на анестетики, лёгкое носовое кровотечение, крайне редко вазовагальные проявления (обморок) и ларингоспазм [Langmore, 2001]. К ограничениям метода можно отнести трудности его выполнения у больных с гиперкинезами и эпилепсией. Введение терапевтических методик в диагностическую оценку глотания, требует от клиницистов умения «читать» и интерпретировать результаты рентгенологического или эндоскопического исследования в процессе их проведения так, чтобы соответствующая терапия была незамедлительно выбрана и назначена [Logemann, 1997].
Двигательную и сократительную активность глотки и пищевода определяют по синхронной записи давления в разных участках пищеварительной трубки. Этот метод называется манометрией. Обычно используют 3-4 наполненных водой катетера, подсоединённых либо к расположенным вне тела датчикам, чувствительным к перемещению объёма, либо к встроенным датчикам, реагирующим на растяжение, передающим информацию на записывающие устройства. Катетеры через рот или нос устанавливают в желудок. Во время глотка и в промежутках между глотками их извлекают до тех пор, пока не будет записано давление с каждого сантиметрового участка пищевода и глотки. Верхний и нижний сфинктеры пищевода в покое представляют собой области самого высокого давления. При каждом глотательном движении, когда сфинктеры расслабляются, в глотке возникает перистальтическая волна, увеличивающаяся по направлению к пищеводу. Манометрия, главным образом, помогает в диагностике и ведении пищеводной дисфагии, при которой нет структурных изменений пищевода и глотки, например, при ахалазии и диффузном спазме пищевода. При ахалазии синхронно с очередным увеличением «глотательной» волны в глотке перистальтические сокращения в пищеводе возникают, но их амплитуда по мере продвижения волны к нижнему отделу пищевода снижается; нижний сфинктер пищевода, находясь в состоянии гипертензии, при глотании всё-таки расслабляется. При склеродермии, наоборот, перистальтика в нижней гладкомышечной части пищевода отсутствует, а давление в нижнем пищеводном сфинктере низкое. При диффузном спазме пищевода в его нижнем отделе регистрируются одновременные сокращения большой амплитуды и продолжительности, которые повторяются. При полимиозите гладкомышечный отдел пищевода не страдает, а поражаются поперечнополосатые волокна мышц глотки, крикофарингеального жома и верхней части пищевода. В результате амплитуда перистальтической волны в глотке и верхней трети пищевода низкая, верхний сфинктер пищевода находится в состоянии гипотензии и не раскрывается при глотании из-за одновременной слабости надподъязычных мышц [Р.К. Гойял, 1996].
Множественность проявлений нейрогенной дисфагии и разнообразие комбинаций симптомов, которые наблюдаются у больных, не позволяют выполнить идентификацию специфичного неврологического заболевания. Однако из многообразия обсуждаемых выше клинических и инструментальных признаков нейрогенных нарушений глотания всё-таки можно выделить несколько симптомокомплексов, которые довольно часто встречаются в неврологической клинике (Таблица 7). Такой подход может быть полезным в процессе диагностического поиска и формулировке функционального диагноза, выбора лечебных и реабилитационных мероприятий или оценке прогноза, как качества жизни, так и её исхода.
Таблица 7. Синдромы нарушения глотания.
Нарушени