Контрольная работа
для студентов заочной формы обучения
1. Направления электрохимической энергетики
2. Классификация химических источников тока (ХИТ).
3. Принцип действия гальванического элемента (ГЭ) – первичного химического источника тока (ХИТ).
4. Электрохимические характеристики гальванического элемента (ГЭ).
5. Существующие первичные химические источника тока (ХИТ).
6. Перспективные первичные химические источники тока (ХИТ).
7. Цинковые гальванические элементы (ГЭ).
8. Магниевые гальванические элементы (ГЭ).
9. Литиевые гальванические элементы (ГЭ).
10. Коммуникация химических источников тока (ХИТ).
11. Электродные и токообразующие реакции в первичных химических источниках тока (ХИТ).
12. Классификация вторичных химических источников тока (ХИТ) – аккумуляторов.
13. Кислотные аккумуляторы.
14. Щелочные аккумуляторы.
15. Аккумуляторы с твердым и расплавленным электролитом.
16. Принцип действия вторичных химических источников тока (ХИТ) – аккумуляторов.
17. Электрохимические характеристики аккумуляторов.
18. Процессы при эксплуатации вторичных химических источников тока (ХИТ) – аккумуляторов.
19. Литиевые аккумуляторы.
20. Никелевые, цинковые аккумуляторы.
21. Свинцовые аккумуляторы.
22. Металловоздушные аккумуляторы, с неводными растворами, с твердыми электролитами, высокотемпературные, редокс-аккумуляторы.
23. Понятие топливного элемента (ТЭ). Классификация топливных элементов.
24. Примеры электрохимических систем, разработанных для топливных элементов.
25. Характеристика окислителей и восстановителей, применяемых в топливных элементах.
26. Виды электрохимических конденсаторов.
27. Наноматериалы в энергетике.
28. Нанотехнологии в энергетике.
29. Химические источники тока для электромобиля.
30. Электрохимические энергоустановки (ЭЭУ) и электрохимические электростанции (ЭЭС).
31. Составьте таблицу электродных потенциалов алюминия в растворах с активными концентрациями  : 1; 0,1; 0,01; 0,0001; 0,00001 моль/л и начертите кривую зависимости электродного потенциала от концентрации ионов.
: 1; 0,1; 0,01; 0,0001; 0,00001 моль/л и начертите кривую зависимости электродного потенциала от концентрации ионов.
32. Вычислите, как изменится электродный потенциал цинкового электрода, если концентрация раствора сульфата цинка, в который погружена цинковая пластинка, уменьшится от 0,1 до 0,01 н (активность частиц a примите равной концентрации с).
33. Вычислите ЭДС гальванического элемента

если  моль/л и
моль/л и 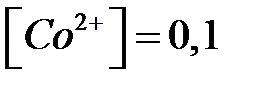 моль/л (активность частиц a примите равной концентрации с).
моль/л (активность частиц a примите равной концентрации с).
34. Имеется концентрационная цепь:
 .
.
Вычислите электродные потенциалы и ЭДС (активность частиц a примите равной концентрации с).
35. Напишите уравнение Нернста для реакции:
 .
.
Рассчитайте значение потенциала данной реакции для активностей ионов  ,
,  , равных 1, и рН среды, равном 1 и 10 при 298 К.
, равных 1, и рН среды, равном 1 и 10 при 298 К.
36. Сравните ЭДС двух концентрационных цепей:
а)  ;
;
б) 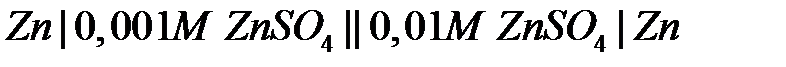
(активность частиц a примите равной концентрации с).
37. Дана концентрационная цепь:
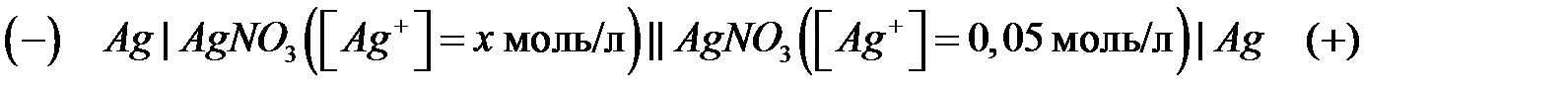 ЭДС цепи
ЭДС цепи  В. Чему равна концентрация раствора
В. Чему равна концентрация раствора  при отрицательном электроде? (Активность частиц a примите равной концентрации с).
при отрицательном электроде? (Активность частиц a примите равной концентрации с).
38. Имеется концентрационная цепь:

ЭДС цепи  В. Определите х. (Активность частиц a примите равной концентрации с).
В. Определите х. (Активность частиц a примите равной концентрации с).
39. Вычислите ЭДС и изменение энергии Гиббса для гальванического элемента, образованного магнием и цинком, погруженными в растворы их солей с концентрациями ионов (моль/л): 
 . Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов. (Активность частиц a примите равной концентрации с).
. Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов. (Активность частиц a примите равной концентрации с).
40. Какие процессы происходят на электродах медного концентрационного гальванического элемента, если у одного из электродов  моль/л, а у другого – 10-3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте, исходя из величины ЭДС и
моль/л, а у другого – 10-3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте, исходя из величины ЭДС и  этой цепи. (Активность частиц a примите равной концентрации с).
этой цепи. (Активность частиц a примите равной концентрации с).
41. ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов  моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов
моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов  в растворе его соли. (Активность частиц a примите равной концентрации с).
в растворе его соли. (Активность частиц a примите равной концентрации с).
42. Исходя из величины стандартных окислительно-восстановительных потенциалов и значения  , определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
, определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
а)  ;
;
б) 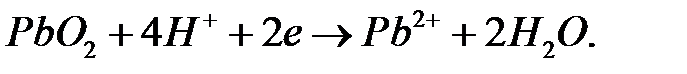
43. Потенциал серебрянного электрода в растворе  составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов
составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов  (в моль/л)? (Активность частиц a примите равной концентрации с).
(в моль/л)? (Активность частиц a примите равной концентрации с).
44. Составьте схему работы гальванического элемента, образованного железом и свинцом, погруженными в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса. (Активность частиц a примите равной концентрации с).
45. При какой концентрации ионов  (моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? (Активность частиц a примите равной концентрации с).
(моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? (Активность частиц a примите равной концентрации с).
46. При какой концентрации ионов  (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? (Активность частиц a примите равной концентрации с).
(моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? (Активность частиц a примите равной концентрации с).
47. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией  моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? (Активность частиц a примите равной концентрации с).
моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? (Активность частиц a примите равной концентрации с).
48. Гальванический элемент составлен по схеме:

Рассчитайте ЭДС этого элемента при стандартных условиях, изменение энергии Гиббса протекающей в нем реакции.
49. Как будет смещаться равновесие в системе при работе составленного из нее гальванического элемента:

Напишите уравнения соответствующих реакций. Определите стандартную ЭДС и  токообразующей реакции.
токообразующей реакции.
50. Нормальные потенциалы олова и свинца равны – 0,14 В и 0,13 В. Покажет ли амперметр ток в гальваническом элементе, образованном из полуэлементов
 ?
?
(Активность частиц a примите равной концентрации с).
51. Имеется концентрационная цепь:
 .
.
Вычислите электродные потенциалы и ЭДС. (Активность частиц a примите равной концентрации с).
52. Концентрационная гальваническая цепь составлена магниевыми электродами, погруженными в растворы  разной концентрации:
разной концентрации:
 .
.
Кажущаяся степень диссоциации в 0,001н MgSO4 равна 87%. Опредедите степень электролитической диссоциации MgSO4 в 2М растворе, если ЭДС цепи равна 0,103 В. Активность частиц a примите равной концентрации с. (Степень диссоциации a равна отношению числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества).
53. Гальванический элемент составлен по схеме:
 .
.
Рассчитайте ЭДС этого элемента при стандартных условиях, найдите изменения энергии Гиббса протекающей в нем реакции. Напишите уравнения электродных и токообразующей реакций.
54. Как будет смещаться равновесие в системе при работе составленного из нее гальванического элемента:

Напишите уравнения соответствующих реакций. Определите стандартную ЭДС и  токообразующей реакции.
токообразующей реакции.
55. Вычислите ЭДС концентрационного элемента, составленного из двух водородных электродов, погруженных в растворы кислот с рН=2 и рН=4.
56. Укажите знаки электродов, направление потока электронов и ЭДС цепи (под обозначениями концентраций соответствующих растворов указаны степени диссоциации электролитов  ; степень диссоциации равна отношению количества молекул, распавшихся на ионы, к общему количеству молекул растворенного вещества):
; степень диссоциации равна отношению количества молекул, распавшихся на ионы, к общему количеству молекул растворенного вещества):
 .
.
Активность частиц a примите равной концентрации с.
57. В каком направлении пойдет ток в гальваническом элементе, состоящем из водородных электродов, находящихся в растворах с рН 2 и рН 13? Какова ЭДС этого элемента?
58. Будет ли работать гальванический элемент, состоящий из водородных электродов, погруженных в 1 н и 0,1 н растворы КОН при 25°С, если кажущаяся степень диссоциации растворов КОН соответственно равна 77 и 91%. Активность частиц a примите равной концентрации с. (Степень диссоциации  равна отношению количества молекул электролита, распавшихся на ионы, к общему количеству молекул растворенного электролита).
равна отношению количества молекул электролита, распавшихся на ионы, к общему количеству молекул растворенного электролита).
59. Обозначьте знаки электродов, укажите направление потока электронов и вычислите ЭДС концентрационной цепи:
 .
.
Активность частиц a примите равной концентрации с.
60. Обозначьте знаки электродов, укажите направление потока электронов и вычислите ЭДС концентрационной цепи:
 .
.
Активность частиц a примите равной концентрации с.
61. –90. Составьте схему и рассчитайте нормальную электродвижущую силу гальванического элемента, в котором обратимо протекала бы следующая реакция (активность частиц a примите равной концентрации с, равной 1):
 .
.
62.
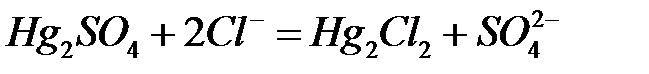 .
.
63.
 .
.
64.
 .
.
65.
 .
.
66.
 .
.
67.
 .
.
68.
 .
.
69.
 .
.
70.
 .
.
71.
 .
.
72.
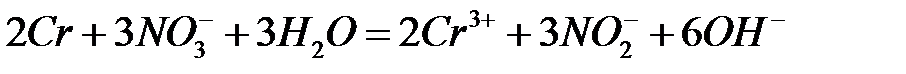 .
.
73.
 .
.
74.
 .
.
75.
 .
.
76.
 .
.
77.
 .
.
78.
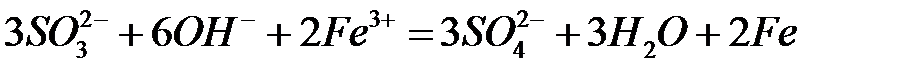 .
.
79.
 .
.
80.
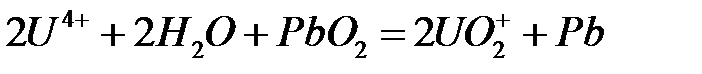 .
.
81.
 .
.
82.
 .
.
83.
 .
.
84.
 .
.
85.
 .
.
86.
 .
.
87.
 .
.
88.
 .
.
89.
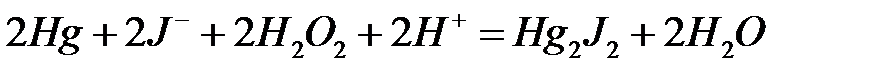 .
.
90.
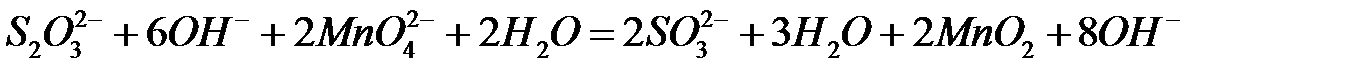 .
.
91. Составьте схемы двух гальванических элементов, в одном из которых кадмий является анодом, а в другом – катодом. Напишите уравнения электродных и токообразующей реакций. Вычислите ЭДС каждого элемента при стандартных состояниях веществ и 298 К, используя термодинамические справочные данные.
92. Проведя термодинамический расчет, определите, за счет какой из реакций (1) или (2) можно реализовать гальванический медно-цинковый элемент с большей ЭДС. Расчет проводите для стандартных состояний всех веществ и 298 К:

93. Рассчитайте константу равновесия реакции, протекающей в серебряно-магниевом элементе:

при стандартных состояниях веществ и 298 К.
94. Рассчитайте стандартную ЭДС кислородно-метанового топливного элемента (ТЭ), в котором протекает реакция:
 при 298 К.
при 298 К.
Вычислите константу равновесия данной реакции.
95. Гарантийный максимум саморазряда свинцового аккумулятора составляет 21% за месяц. Какой минимальной емкостью может обладать свинцовый аккумулятор типа СТ-80 фактической емкостью 84 А×ч после месяца бездействия в заряженном состоянии?
96. Используя схему гальванического элемента (ГЭ):
 ,
,
составьте уравнения электродных и токообразующей реакций.
Рассчитайте ЭДС элемента при 298 К при концентрации 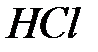 , равной 0,1 моль/л, концентрации
, равной 0,1 моль/л, концентрации  , равной 0,025 моль/л и давлении водорода
, равной 0,025 моль/л и давлении водорода  .
.
97. Для питания различной аппаратуры используется сухой марганцево-цинковый элемент:
 .
.
Какова должна быть минимальная масса цинкового анода, для получения 3 Вт×ч энергии при ЭДС элемента, равной 1,5 В? Составьте уравнение анодной реакции.
98. Свежезаряженный железо-никелевый аккумулятор имеет емкость 25 А×ч. После трехмесячного бездействия в заряженном состоянии аккумулятор отдал при разрядке 15 А×ч. Какова величина саморазряда аккумулятора за месяц?
99. Используя значение ЭДС элемента
 ,
,
равное 1,4 В, рассчитайте максимальный объем восстановленного кислорода при получении 14 Вт×ч энергии при нормальных условиях.
Составьте уравнение катодной реакции.
100. Определите теоретически возможное количество электричества, энергии и удельной энергии, которые можно получить в гальваническом элементе с исходной массой кадмия, равной 11,2 г и эквивалентной ей массой ионов меди при 298 К и активностях ионов 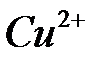 и
и 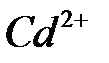 равных 1.
равных 1.
Схема элемента:  .
.
101. Какой объем кислорода, измеренного при нормальных условиях, расходуется за 5 ч работы водородно-кислородного топливного элемента (ТЭ), разряжающегося непрерывным током 0,1 А?
Определите теоретически возможное количество электричества и энергии, которые можно получить в элементе на 1 моль кислорода при стандартных состояниях веществ и температуре 298 К.
102. Определите максимальное время работы элемента
 ,
,
разряжающегося непрерывным током, равным 0,5 А, если в элементе заложено 6,5 г цинка, которые будут полностью израсходованы.
Составьте токообразующую реакцию и рассчитайте стандартную ЭДС этого элемента при 298 К, используя справочные термодинамические величины.
103. Определите ЭДС кислородно-водородного топливного элемента, работающего при температуре 25°С, рН 10 и  .
.
Рассчитайте максимальное время работы этого элемента при постоянном токе 0,27 А с исходным наличием в баллонах 11,2 л водорода и 5,6 л кислорода.
104. Рассчитайте ЭДС свинцового аккумулятора, в качестве электролита в котором используется раствор серной кислоты с активностью ионов Н+, равной 6 моль/л, активностью ионов  – 3 моль/л и активностью воды – 0,72 моль/л.
– 3 моль/л и активностью воды – 0,72 моль/л.
105. Щелочной аккумулятор типа НЖ-60, имеющий габариты 45х349х128 мм и массу 4,07 кг, отдал свою емкость за 8 ч 52 мин при разрядке током 7,5 А; среднее разрядное напряжение аккумулятора  В. Каковы удельные характеристики аккумулятора?
В. Каковы удельные характеристики аккумулятора?
106. Батарея свинцовых аккумуляторов типа ЗСТ-20 имеет габариты 194х257х230 мм и массу 19,2 кг. При разряде током 7,0 А батарея должна работать не менее 10 ч; при этом среднее разрядное напряжение батареи равно 6,0 В. Каковы удельные емкость и энергия батареи на этом режиме?
107. Сухой марганцево-цинковый элемент типа 1,6 ФМЦ-у-3,2 диаметром 34 и высотой 64 мм имеет массу 105 г. При разряде на сопротивление 10 Ом элемент проработал 34 ч при среднем напряжении 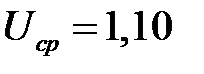 В. Каковы удельные характеристики элемента?
В. Каковы удельные характеристики элемента?
108. Батарея из 70 марганцево-цинковых элементов типа 100 АМГЦ-у-2,0, габаритами 218х138х73 мм имеет массу 3,35 кг. При ее полном разряде на сопротивление 7000 Ом батарея имела среднее напряжение  В и проработала 170 ч. Каковы удельные характеристики батареи?
В и проработала 170 ч. Каковы удельные характеристики батареи?
109. – 120. Дана схема гальванического элемента. Для данного ГЭ:
а) определите анод и катод;
б) составьте уравнения процессов, протекающих на аноде и катоде;
в) запишите уравнение токообразующей реакции;
г) рассчитайте стандартное изменение энергии Гиббса при протекании токообразующей реакции при 298 К и стандартную электродвижущую силу (двумя способами);
д) рассчитайте теоретически возможное количество электричества и энергии, которые можно получить в ГЭ на 1 моль металла или газа при стандартном состоянии веществ и 298 К:
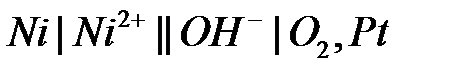 .
.
110.
 .
.
111.
 .
.
112.
 .
.
113.
 .
.
114.
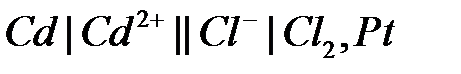 .
.
115.
 .
.
116.
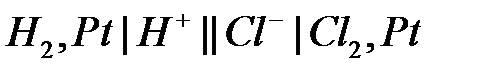 .
.
117.
 .
.
118.
 .
.
119.
 .
.
120.
 .
.
121. Железный предмет общей площадью 0,08 помещен в качестве катода в раствор соли никеля. Какова толщина отложившегося слоя никеля? Плотность никеля 8900. Ток силой 3,15 А пропускали в течение 42 мин.
122. Деталь подвергалась марганцеванию. Электролит – раствор  . Сила тока 5 А. вычислите выход металла – покрытия (марганца) по току, если в течение 1 ч на поверхности детали выкристаллизовалось 3,078 г чистого марганца.
. Сила тока 5 А. вычислите выход металла – покрытия (марганца) по току, если в течение 1 ч на поверхности детали выкристаллизовалось 3,078 г чистого марганца.
123. При пропускании тока через водный раствор хлорида кобальта (II) в течение 50 мин. на катоде выделилось 56 г  . Какой газ и в каком объеме выделился на аноде при электролизе водного раствора этой соли при
. Какой газ и в каком объеме выделился на аноде при электролизе водного раствора этой соли при 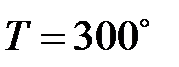 и
и  ? Составьте уравнения электродных процессов.
? Составьте уравнения электродных процессов.
124. Через последовательно включенные в цепь постоянного тока растворы  и
и 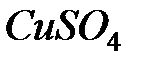 пропускался ток в 5 А в течение 10 мин. Какая масса каждого металла выделится при этом на катодах?
пропускался ток в 5 А в течение 10 мин. Какая масса каждого металла выделится при этом на катодах?
125. Вычислите время, в течение которого должен быть пропущен ток в 1,5 А через раствор цинковой соли, чтобы покрыть металлическую пластинку слоем цинка толщиной  м, если общая площадь поверхности пластинки 0,1 м
м, если общая площадь поверхности пластинки 0,1 м  , а выход по току 90,5% (плотность цинка 7133кг/м
, а выход по току 90,5% (плотность цинка 7133кг/м  ).
).
126. Закончить уравнения реакций и расставить коэффициенты. В каком направлении протекает реакция?
Cu2S + HNO3  Cu(NO3)2 + H2SO4 + NO2 +...
Cu(NO3)2 + H2SO4 + NO2 +...
127. Закончить уравнения реакций и расставить коэффициенты. В каком направлении протекает реакция?
As2S3 + HNO3 + H2O  H3AsO4 + H2SO4 + NO.
H3AsO4 + H2SO4 + NO.
128. Может ли перманганат калия окислить в кислой среде производные Сr (III) до Cr (VI)? Покажите на примере.
129. Может ли концентрированная азотная кислота окислить свинец до PbO2; олово - до SnO2? Приведите примеры.
130. Можно ли использовать PbO2 в качестве окислителя для осуществления в стандартных условиях реакций:
а) Mn2+ + 4H2O – 5e = MnO 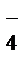 + 8H+;
+ 8H+;
б) 2Cr3+ + 7H2O – 6e = Cr2O  + 14H+.
+ 14H+.
131. В каком направлении при стандартных условиях протекают реакции:
а) P2S3 + HNO3 конц .(+H2O?)  H3PO4 + H2SO4 + NO;
H3PO4 + H2SO4 + NO;
б) P2S5 + HNO3 конц .(+H2O?)  H3PO4 + H2SO4 + NO2.
H3PO4 + H2SO4 + NO2.
132. В каком направлении при стандартных условиях протекают реакции:
а) NH4HS + HNO3 конц., изб.  N2 + H2SO4 + NO;
N2 + H2SO4 + NO;
б) FeSO4 + HNO3  Fe(NO3)3 + NO2 + H2SO4 + H2O.
Fe(NO3)3 + NO2 + H2SO4 + H2O.
133. В каком направлении при стандартных условиях протекают реакции:
а) FeS2 + HNO3 конц  Fe(NO3)3 + NO + H2SO4 + H2O;
Fe(NO3)3 + NO + H2SO4 + H2O;
б) H2S + HNO3 конц., изб.  H2SO4 + NO + H2O.
H2SO4 + NO + H2O.
134. Напишите уравнения реакций взаимодействия между:
а) йодидом водорода и азотистой кислотой, при этом азотистая кислота восстанавливается до оксида азота (II);
б) медью и концентрированной азотной кислотой.
135. Напишите следующие уравнения реакций:
а) сульфида кадмия с азотной кислотой, при этом образуется элементарная сера и оксид азота (II);
б) алюминия с дихроматом калия, в сернокислой среде, при этом дихромат калия восстанавливается до сульфата хрома (III).
136. Закончите уравнения реакций окисления - восстановления с участием KMnO4, учитывая при этом, что  в KMnO4 в кислой среде восстанавливается до
в KMnO4 в кислой среде восстанавливается до  , в щелочной - до
, в щелочной - до  .
.
а) H3PO3 + KMnO4 + H2SO4  H3PO4 +...
H3PO4 +...
б) Na3AsO3 + KMnO4 + KOH  Na3AsO4 +...
Na3AsO4 +...
137. По приведенным ниже электронно-ионным схемам реакций составьте уравнения окислительно-восстановительных реакций (в молекулярном виде):
а) 10Fe2+ – 10e– = 10Fe3+;
2MnO 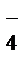 + 10e– + 16H+ = 2Mn2+ + 8H2O;
+ 10e– + 16H+ = 2Mn2+ + 8H2O;
б) 3Mg0 – 6e– = 3Mg2+;
SO  + 6e– + 8H+ = S0 + 4H2O;
+ 6e– + 8H+ = S0 + 4H2O;
138. Какой из окислителей - MnO2, PbO2, K2Cr2O7 - является наиболее эффективным по отношению к Hcl при получении cl2?
139. В каком направлении будет протекать реакция?
СrCl3 + Br2 + KOH  K2CrO4 + KBr + H2O
K2CrO4 + KBr + H2O
140. Можно ли при стандартных условиях окислить хлорид водорода до cl2 с помощью серной кислоты? Ответ подтвердите расчетом  .
.
141. Какой объем 2 Н Нbr необходим для взаимодействия с 0,25 моль K2Cr2O7:
Нbr + K2Cr2O7  Kbr + CrBr3 + Br2 + H2O
Kbr + CrBr3 + Br2 + H2O
Какой объем брома при этом выделится?
142. Какую массу Al можно окислить с помощью 0,1 л 0,25 Н K2Cr2O7 по реакции: Al+K2Cr2O7+H2SO4  Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O
Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O
143. К подкисленному раствору KJ добавлено 0,04 л 0,3 Н KNO2:
KJ + KNO2 + H2SO4  J2 + K2SO4 + NO + H2O
J2 + K2SO4 + NO + H2O
Вычислите массу выделившегося йода и объем NO.
144. Смешаны подкисленные растворы: а) KNO3 и KMnO4; б) Fe2(SO4)3 и K2Cr2O7. Между какими из этих веществ будет протекать реакция и чем это определяется?
145. Могут ли одновременно существовать в растворе HJ и HClO3, Hbr и KMnO4?
146. Будет ли азотистая кислота: а) окисляться действием KMnO4 в нейтральной и кислой средах; б) восстанавливаться до NO сернистой кислотой? Для возможных случаев напишите уравнения реакций.
147. В кислый раствор, содержащий смесь солей Kcl, Kbr и KJ добавлено достаточное количество KNO2. Записать редокси-цепи, выражающие взаимодействие NO2-иона с каждым по отдельности галогенид-ионом (один из электродов NO  + 2H+/NO + H2O). Сопоставлением электродных потенциалов установить, какой из галогенид-ионов будет окисляться до свободного состояния и какие не будут. Для окисляющегося галогенид-иона написать молекулярное уравнение реакции.
+ 2H+/NO + H2O). Сопоставлением электродных потенциалов установить, какой из галогенид-ионов будет окисляться до свободного состояния и какие не будут. Для окисляющегося галогенид-иона написать молекулярное уравнение реакции.
148. В подкисленный раствор смеси солей Kcl, Kbr и KJ прибавлен в достаточном количестве раствор KMnO4. Записать редокси-цепи для каждого галогенид-иона, обозначить электродные потенциалы, отметить знаки полюсов, направление перемещения электронов: вычислить ЭДС цепей. Все ли галогенид-ионы могут быть окислены до свободного состояния действием перманганат-иона? Написать соответствующие ионные уравнения реакций окисления-восстановления. Какая из трех рассматриваемых реакций будет протекать наиболее и какая наименее интенсивно?
149. К раствору сульфида натрия прибавлена азотная кислота. Жидкость мутнеет вследствие образования свободной серы. Написать ионное уравнение реакции. Записать редокси-цепь, отвечающую данному случаю. Указать электрод-восстановитель и электрод-окислитель, направление перемещения электронов и ЭДС цепи.
150. Можно ли окислить Cr2(SO4)3 действием KMnO4 в кислой среде с получением K2Cr2O7? Записать электронно-ионные уравнения фаз восстановления и окисления (по типу ВФ2–ne–  ОФ2 и ОФ1+ne–
ОФ2 и ОФ1+ne–  ВФ1). Записать редокси-цепь, указать знаки полюсов. Вывести молекулярное уравнение протекающей реакции.
ВФ1). Записать редокси-цепь, указать знаки полюсов. Вывести молекулярное уравнение протекающей реакции.
151. Составить таблицу электродных потенциалов алюминия в растворах с активными концентрациями Al3+: 1; 0,1; 0,01; 0,0001; 0,00001 моль/л и начертить кривую зависимости электродного потенциала от концентрации ионов.
152. Вычислить, как изменится электродный потенциал цинка, если концентрация раствора сульфата цинка, в который погружена цинковая пластинка, уменьшится от 0,1 до 0,01 н.
153. Вычислить ЭДС гальванического элемента Ni/NiSO4||CoSO4/Co,
если [Ni2+]=0,001 моль/л и [Со2+]=0,1 моль/л.
154. Вычислить ЭДС концентрационного элемента, составленного из двух водородных электродов, погруженных в растворы кислот с рН=2 и рН=4.
155. Имеются концентрационные цепи:
а) Ag/0,1 Н AgNO3 || 0,01 Н AgNO3/Ag;
б) Zn/0,0001 г-ион/л Zn2+|| 0,01 г-ион/л Zn2+/Zn
В отношении каждой из этих цепей вычислить электродные потенциалы и ЭДС.
156. Обозначить знаки электродов, указать направление потока электронов и вычислить ЭДС концентрационных цепей:
а) Pt, H2/0,001 Н Hcl || 0,02 M H2SO4/ H2, Pt;
б) Pt, H2/0,00001 Н Hcl || вода/ H2, Pt.
157. Сравнить ЭДС двух концентрационных цепей:
а) Zn/0,01 М ZnSO4 || 0,1 M ZnSO4/Zn;
б) Zn/0,001 М ZnSO4 || 0,01 M ZnSO4/Zn.
158. Указать знаки полюсов, направление потока электронов и ЭДС цепи (под обозначениями концентраций соответствующих растворов указаны степени диссоциации электролитов α):
Ag/0,001 Н AgNO3 || 0,01 Н AgNO3/Ag
α = 1 α = 0,6
159. Дана концентрационная цепь
+Ag/[Ag+] = 0,05 г-ион/л || [Ag+] = х г-ион/л/Ag–
ЭДС цепи Е = 0,118 В. Чему равна концентрация раствора AgNO3 при отрицательном электроде?
160. Имеется концентрационная цепь
+Cu/[Cu2+] = 0,1 г-ион/л || [Cu2+] = х г-ион/л/Cu–
Е - 0,059 В. Определить х.
161. Вычислите ЭДС и изменение энергии Гиббса для гальванического элемента, образованного магнием и цинком, погруженными в растворы их солей с концентрациями ионов (моль/л): С 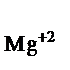 = 1,8
= 1,8  10–5, С
10–5, С  = =2,5
= =2,5  10–2. Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов.
10–2. Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов.
162. Какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов С  = 1 моль/л, а у другого - 10–3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте исходя из величины ЭДС и
= 1 моль/л, а у другого - 10–3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте исходя из величины ЭДС и  этой цепи.
этой цепи.
163. ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов Ni2+ 10–4 моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли.
164. Концентрационная гальваническая цепь составлена магниевыми электродами, погруженными в растворы MgSO4 разной концентрации: Mg/2 М MgSO4 || Mg/0,001 Н MgSO4
Кажущаяся степень диссоциации в 0,001 Н MgSO4 равна 87%. Определите степень электролитической диссоциации MgSO4 в 2М растворе, если ЭДС цепи равна 0,103 В.
165. Исходя из величины стандартных окислительно-восстановительных потенциалов и значения  , определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
, определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
а) 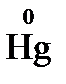 – 2e– = Hg2+;
– 2e– = Hg2+;
б) PbO2 + 4H+ + 2e– = Pb2+ + 2H2O
166. Будет ли работать гальванический элемент, состоящий из водородных электродов, погруженных в 1 Н и 0,1 Н растворы КОН при 250С, если кажущаяся степень диссоциации растворов КОН соответственно равна 77 и 91%?
167. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ (в моль/л)?
168. Составьте схему работы гальванического элемента, образованного железом и свинцом, погруженными в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса.
169. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
170. При какой концентрации ионов Cu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода?
171. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
172. Гальванические элементы составлены по схемам:
а) Fe3+/Fe2+ || Ag+/Ag;
б) ClO  + 6H+/Cl– + 3H2O || 2J–/J2.
+ 6H+/Cl– + 3H2O || 2J–/J2.
Рассчитайте ЭДС этих элементов при стандартных условиях и найдите изменение энергии Гиббса протекающих в них реакций, уравнения которых напишите в ионно-молекулярной и молекулярной формах.
173. Как будет смещаться равновесие в системах при работе составленного из них гальванического элемента:
а) CrO  +2H2O/CrO
+2H2O/CrO  +4OH– и ClO–+2H+/Cl–+H2O;
+4OH– и ClO–+2H+/Cl–+H2O;
б) MnO2+4H+/Mn2++2H2O и NO  +H2O/NO
+H2O/NO 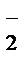 +2OH–.
+2OH–.
Напишите уравнения соответствующих реакций. Определить ЭДС и 
174. Нормальные потенциалы олова и свинца равны –0,14 В и –0,13 В. Покажет ли амперметр ток в гальваническом элементе, образованном из полуэлементов Sn|Sn2+ Cм = 1 моль/л || Pb2+ Cм= 0,46 моль/л |Pb.
175. В каком направлении пойдет ток в гальваническом элементе, состоящем из водородных электродов, находящихся в растворах с рН 2 и рН 13? Какова ЭДС этого элемента?
176. Одной и той же силы ток одновременно пропускался через водный раствор H2SO4 и (в отдельном электролизере) через расплав хлористого цинка. В результате электролиза раствора серной кислоты получено 200 мл водорода, измеренных при 250 и 740 мм рт.ст. (газ сухой). Сколько теоретически должно выделиться цинка на катоде второго электролизера?
177. Электрический ток силой в 6 А в течение 1 ч 14 мин 24 сек осадил на катоде 8,14 г металла из химического соединения, в котором он двухвалентен. Чему равна атомная масса металла и какой это металл?
178. Электролизер содержит раствор Pb(NO3)2, анод свинцовый. Сила тока 5 А, продолжительность электролиза 2 ч 40 мин 50 сек. Вычислить теоретическую убыль в весе свинцового анода в результате электроокисления.
179. Деталь подверглась марганцеванию. Электролит - раствор MnSO4. Сила тока 5 А. Вычислить выход металла- покрытия (марганца) по току, если в течение 1 ч на поверхности детали выкристаллизовалось 3,078 г чистого марганца.
180. При электролизе водного раствора хлористого натрия было получено 600 мл 1 Н раствора NaOH (электролиз проводился с применением диафрагмы). В течение того же времени в серебряном кулонометре, включенном последовательно в цепь и содержащем раствор AgNO3, на катоде выделилось 52,56 г металлического серебра. Вычислить выход едкого натра в процентах от теоретического.
181. Деталь была оцинкована з