Специфичность действия ферментов
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
Модель «ключ-замок»
В 1890 г. Эмиль Фишер предположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата[11]. Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Модель индуцированного соответствия
В 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок»[12]. Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».
|
|
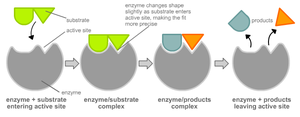
Гипотеза Кошланда об индуцированном соответствии
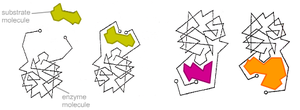
Более реалистичная ситуация в случае индуцированного соответствия. Неправильные субстраты — слишком большие или слишком маленькие — не подходят к активному центру.
Множественные формы ферментов
Множественные формы ферментов можно разделить на две категории:
- Изоферменты.
- Собственно множественные формы (истинные).
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
- Органные — ферменты гликолиза в печени и мышцах.
- Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
- Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
- Мутантные — образуются в результате единичной мутации гена.
- Аллоферменты — кодируются разными аллелями одного и того же гена.
Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию.
|
|
Отличие: изоферменты разные на генетическом уровне и отличаются первичной последовательностью, а истинные множественные формы становятся разными на посттрансляционном уровне.
Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.
Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам.
Примером (1) фермента, имеющего изоферменты, является гексокиназа, имеющая четыре изотипа, обозначаемых римскими цифрами от I до IV. При этом один из изотипов гексокиназы, а именно гексокиназа IV, экспрессируется почти исключительно в печени и обладает особыми физиологическими свойствами, в частности её активность не угнетается продуктом её реакции глюкозо-6-фосфатом.
|
|
Ещё одним примером (2) фермента, имеющего изоферменты, является амилаза — панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Это послужило основой для разработки и применения более надёжного метода диагностики острого панкреатита путём определения не общей амилазы плазмы крови, а именно панкреатической изоамилазы.
Третьим примером (3) фермента, имеющего изоферменты, является креатинфосфокиназа — изотип этого фермента, экспрессируемый в сердце, отличается по аминокислотной последовательности от креатинфосфокиназы скелетных мышц. Это позволяет дифференцировать повреждения миокарда (например, при инфаркте миокарда) от других причин повышения активности КФК, определяя миокардиальный изотип КФК в крови.