Атомы взаимодействуют между собой, как правило, валентными электронами. Валентность атомов – общее число связей атома и их знак. Число валентностей определяется числом участвующих в связи электронов, а знак – распределением зарядов. Различаются следующие виды связи:
1.5.1.Ионная связь.
В основе ионной связи лежит закон Кулона. Ионная связь осуществляется таким образом, что при взаимодействии атомов один из них перетягивает от другого электрон или несколько электронов и становится отрицательно заряженным ионом - анионом, тогда как другой становится положительно заряженным ионом - катионом. Между разнозаряженными ионами образуется электростатическая связь. При отрыве электронов от нейтрального атома для превращения его в катион затрачивается энергия, называемая потенциалом ионизации (точнее сказать катионизации); она измеряется в электрон-вольтах (один электрон-вольт равен энергии, которую приобретает электрон при прохождении ускоряющей разности потенциалов в 1 в; 1 эв= 1,60-10-12 эрг = 3,84-Ю-23 ккал). При приобретении электрона атомом затрачивается энергия, называемая сродством к электрону, необходимая для удержания электрона. Суммарная способность атомов к отрыву электрона и его удержанию называется электроотрицательностью. Образование ионной связи обусловливается тенденцией атомов к приобретению наиболее устойчивой оболочки с полным числом электронов во внешнем слое. Это и достигается, так сказать, «округлением» числа внешних электронов до нужного или путем отдачи излишних, или путем дополнения недостающими. Типичным примером ионной связи между атомами Na и Cl в кристаллической структуре пищевой соли(галите- NaCl) (Рис.1.5.1.1.).
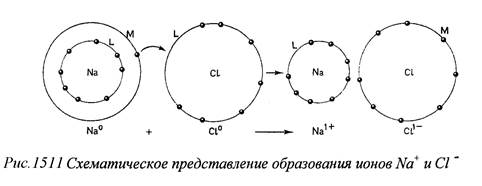 |
1.5.2.Ковалентная связь.
 Ковалентная связь возникает непосредственно между атомами, она не сопровождается образованием ионов. Связь эта осуществляется, когда взаимодействующие атомы имеют холостые электроны с противоположно ориентированными спинами. При этом электроны спариваются и получают возможность одновременно находиться в поле одного и другого атомов(Рис.1.5.2.1.). В качестве причины, вызывающей соединение атомов ковалентной связью опять выступает тенденция в первую очередь к заполнению внешнего электронного слоя до полного числа s- плюс р-электронов по образцу 8-электронного слоя благородного газа.
Ковалентная связь возникает непосредственно между атомами, она не сопровождается образованием ионов. Связь эта осуществляется, когда взаимодействующие атомы имеют холостые электроны с противоположно ориентированными спинами. При этом электроны спариваются и получают возможность одновременно находиться в поле одного и другого атомов(Рис.1.5.2.1.). В качестве причины, вызывающей соединение атомов ковалентной связью опять выступает тенденция в первую очередь к заполнению внешнего электронного слоя до полного числа s- плюс р-электронов по образцу 8-электронного слоя благородного газа.
Рис. 1.5.2.1. Соединение атомов в молекуле H2 ковалентной связью. Белое- плотность электронного заряда. Электронные оболочки (светлое) находятся в общем пользовании атомов.
Этот тип связи характерен прежде всего для соединения атомов одного и того же химического элемента(Рис.1.5.2.2.), а также для большинства органических соединений, но ковалентная связь широко распространена и в сложных минеральных соединениях.

Рис.1.5.2.2. Соединение атомов селена посредством уголковой ковалентной связи
В ионных и ковалентных кристаллах внешние электроны связаны с определенными атомами, поэтому такие кристаллы обычно не проводят электричества и относятся к изоляторам.
1.5.3.Металлическая связь.
 Возникает между атомами определенной группы элементов – металлами. Особенностью ее является способность атомов отдавать в общее пользование электроны, находящиеся во внешней оболочке и превращаться в положительную частицу – ион, «атомный остов». Соединение металлического типа представляет собой совокупность «атомных остовов», плотно упакованных, между которыми свободно перемещаются электроны в виде «электронного газа»(Рис.1.5.3.1.).
Возникает между атомами определенной группы элементов – металлами. Особенностью ее является способность атомов отдавать в общее пользование электроны, находящиеся во внешней оболочке и превращаться в положительную частицу – ион, «атомный остов». Соединение металлического типа представляет собой совокупность «атомных остовов», плотно упакованных, между которыми свободно перемещаются электроны в виде «электронного газа»(Рис.1.5.3.1.).
Это обуславливает способность металлов проводить электрический ток.
Рис.1.5.3.1. Схема «атомного остова» из положительно заряженных частиц и заполняющего пространство между ними «электронного газа» в соединениях атомов металлического типа.
1.5.4.Молекулярная связь.
Возникает между молекулами вещества, в результате их поляризации от различных причин. Связь очень слабая, соединения легко разрушаются. Наибольшее значение имеет дисперсионный эффект, вызываемый тем, что в молекуле электроны движутся и создают мгновенные диполи, способные создать притяжение между молекулами. Вместе с тем молекулы вообще могут быть в той или иной мере полярными, т. е. опять получится взаимодействие диполей, но совершенно иного масштаба, называемое ориентационным эффектом. Наконец, появляются еще одни силы в виде наведенного или индукционного эффекта, связанные с поляризующим действием электрических полей соседних молекул. В разных соединениях соотношение этих сил сильно колеблется, в частности у полярных молекул, каковыми являются молекулы воды H2O (из них строится минерал лед), естественно возрастает роль ориентационного эффекта, выходящего на первое место: для воды ориентационный эффект 190,0, дисперсионный эффект 47,0 и наведенный 10,0 эрг·10-6.
1.5.5.Другие типы связей.
Кроме перечисленных связей, между атомами наблюдаются также: донорно-акцепторные, смешанные и промежуточные связи. Последние - наиболее вероятные и реальные связи в минералах. Все вышеописанные связи представляют примеры чистых теоретических соединений. В большинстве случаев в реальных кристаллах связи имеют промежуточный характер, т.е. одновременно реализуются ионная, ковалентная и др. связи.
Физические свойства (электропроводность, плотность, твердость и др.) любого твердого тела являются прежде всего результатом поведения наружных валентных электронов, а их взаимодействие между собой и с соседними атомными остовами определяется преобладанием определенно типа химической связи (металлической – ковалентной – ионной). В общем случае минералы с преобладанием металлической связи характеризуются низкой твердостью, высоким коэффициентом поглощения, пластичностью. При увеличении в минералах доли ковалентной связи возрастает твердость, плотность, уменьшается пластичность и увеличивается показатель преломления. Известно также, что у них длинноволновый край полосы собственного поглощения, т.е. максимальное поглощение и отражение, смещается в область больших энергий. При преобладании ионной составляющей твердость увеличивается, плотность уменьшается, уменьшается также показатель поглощения и показатель преломления.
1.6.Типы кристаллических решеток минералов.
Каждый минерал является закономерным сообществом атомов различных элементов, соединенных друг с другом одним или несколькими типами связей, описанных выше. Основой кристаллической структуры является элементарная ячейка – минимальное количество атомов входящих в состав минерала, соединенных определенным образом, модель которого повторяется бесконечно в любом направлении. Устойчивость кристаллической решетки минералов определяется ее энергией, зависящей от: количества структурных единиц, от их размеров, от их валентостей, от поляризационных свойств атомов. Благодаря этому каждый минерал может образовывать твердые тела – кристаллы, обладающие индивидуальными формами и только им присущими физическими свойствами. В зависимости от особенностей атомов, проявляющихся в условиях образования минералов, получаются соединения атомов одного и того же химического элемента или соединяются друг с другом атомы различных элементов. Состав и структура минералов взаимно связаны, так как каждое сочетание атомов может иметь при данных условиях образования минерала лишь определенную структуру. В зависимости от того какие связи между атомами атомов присутствуют в структуре минерала выделяются: гомодесмические, гетеродесмические, мезодесмические и некристаллические типы соединений.
Модели кристаллических структур минералов изображаются разными способами, главные приведены на (рис.1.6.1.).
 |
1.6.1.Гомодесмические соединения имеют структуру, в которой связи только одного типа — ионные, ковалентные или металлические и они одинаковы по всем направлениям. Такие соединения далее подразделяются по характеру связи. В гомодесмических ионных минералах катионы и анионы соединяются друг с другом так, что каждый ион имеет всех соседей на равных расстояниях от себя (рис.1.6.1.1.).


Рис. 1.6.1.1. Кристаллическая решетка (а) и форма кристалла (б) типичного ионного соединения каменной соли - галита (NaCl). Цифрами обозначены основные грани кристалла.
Понятно, что от минерала к минералу может меняться не только число соседей у ионов, но и симметрия структуры. Гомодесмические ковалентные минералы строятся также путем равномерного окружения одних атомов другими на равном удалении соседей. Например в структуре алмаза (рис.1.6.1.2.) каждый атом углерода, с тетраэдрически расположенными связями, окружается четырьмя соседями на одинаковом расстоянии в 1,54 кХ..
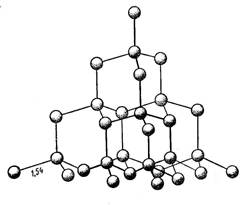
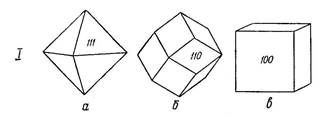
Рис.1.6.1.2. Кристаллическая структура алмаза и главные формы его кристаллов.
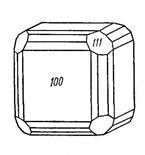
В гомодесмических соединениях с металлическим типом связи окружение атомов опять равномерное и расстояния между атомами равные. Самородная медь (Рис.1.6.1.3.) устроена так, что каждый атом, «атомный остов» окружается двенадцатью такими же соседями, центры которых отстоят один от другого на 2,55 кХ.
 а а
|  б б
|
Рис. 1.6.1.3. Модель кристаллической структуры меди и форма ее кристалла.
В целом минералы с гомодесмическим типом соединения атомов обладают, как правило, индивидуальными изотропными свойствами, характерными только для данного соединения, устойчивыми во всех направлениях, малыми вариациями свойств, поддаются измельчению до предельно малых частиц.
1.6.2.Гетеродесмические соединения образуются соединением атомов с различными связями (греч. гетерод означает другой, различающийся). Соединения имеют в разных частях кристаллов и по разным направлениям неодинаковые связи. Из-за этого в гетеродесмических минералах выделяются группы атомов, соединенные друг с другом одним образом, тогда как соединение между группами осуществляется другим образом. Разделение таких соединений основывается прежде всего на устройстве обособляющихся в них групп атомов, выделяются: островные, цепочечные, слоистые и каркасные группы.
В гетеродесмических соединениях с островными группами имеются со всех сторон обособленные в той или иной степени группы. Форма групп различна, но они все подчиняются общему закону построения кристаллохимических ячеек минералов. Островные группы установлены в структурах многих минералов. При этом в одних гетеродесмических соединениях с островными группами имеются ковалентные и молекулярные связи (Рис.1.6.2.1.). В них наблюдаются группы атомов, образующие молекулы (Sb4O6). Внутри молекул связи, как это специфично для них, ковалентные, но между собой такие группы связываются в общую постройку при помощи молекулярных связей.

Рис. 1.6.2.1. Ковалентно - молекулярный тип островного соединения сенармонита Sb2O3
 В других гетеродесмических соединениях с островными группами связи носят ковалентныи и ионный характер или даже с тремя типами связей: ковалентной, ионной и молекулярной (Рис.1.6.2.2.). Здесь внутри островных групп имеется ковалентная или смешанная ковалентная и ионная связь, а между группами связи ионного характера. К последнему случаю гетеродесмических соединений относится структура гипса Ca[SO4]∙2H2O. В этом минерале имеются островные группы- сульфат-ионы [SO4]-2 с преимущественно ковалентными связями между серой и кислородом, которые соединяются друг с другом через катионы кальция, кроме того, в структуре имеются прокладки из молекул воды, по которым реализуется совершенная спайность.
В других гетеродесмических соединениях с островными группами связи носят ковалентныи и ионный характер или даже с тремя типами связей: ковалентной, ионной и молекулярной (Рис.1.6.2.2.). Здесь внутри островных групп имеется ковалентная или смешанная ковалентная и ионная связь, а между группами связи ионного характера. К последнему случаю гетеродесмических соединений относится структура гипса Ca[SO4]∙2H2O. В этом минерале имеются островные группы- сульфат-ионы [SO4]-2 с преимущественно ковалентными связями между серой и кислородом, которые соединяются друг с другом через катионы кальция, кроме того, в структуре имеются прокладки из молекул воды, по которым реализуется совершенная спайность.
Рис. 1.6.2.2.. Ковалентно-ионно-молекулярное островное соединение решетки гипса и формы его кристаллов.
В гетеродесмических соединениях островные группы могут располагаться, образуя различные узоры. В одних из них изолированные группы соединяются друг с другом при помощи тех или иных связей равномерно во все стороны, так что может получиться даже кубическая симметрия, как в сенармонтите (Рис.1.6.2.1). В других минералах такого типа отдельные группы укладываются рядами, а в некоторых случаях островные группы располагаются слоями, как, например, в гипсе, в котором имеются также и слои из молекул Н2О. С учетом таких особенностей гетеродесмических минералов с островными группами возможна их более подробная классификация.
В гетеродесмических соединениях с цепочечными группами в минерале наблюдаются «бесконечные» группировки атомов в виде цепочек различного устройства со связями одного характера вдоль цепочки и другого характера между цепочками. И в этом случае подразделение соединений осуществляется прежде всего на основании характера связей. Сначала отметим такие гетеродесмические соединения с ковалентными и молекулярными связями. Ранее рассмотренный самородный селен может служить примером этого рода соединений(Рис. 1.5.2.2.). Атомы этого элемента имеют по две направленные под углом в 105° ковалентиые связи и при их помощи атомы соединяются в «бесконечные» цепочки, которые можно рассматривать как чрезвычайно протяженные в одном направлении 'молекулы. Кристалл строится путем соединения цепочек в параллельном положении посредством молекулярной связи.
 В некоторых гетеродесмических соединениях с цепочечной структурой наблюдаются ковалентные и ионные связи. Такие цепочечные соединения встречаются среди минералов силикатов. Так, например, весьма распространенные в природе минералы пироксены строятся из цепочек, составленных из тетраэдрических групп [SiO4]-(Рис.1.6.2.3.). В пироксенах тетраэдры соединяются друг с другом в «бесконечные» цепочки, используя для этого по две своихвершины - атомы кислорода,
В некоторых гетеродесмических соединениях с цепочечной структурой наблюдаются ковалентные и ионные связи. Такие цепочечные соединения встречаются среди минералов силикатов. Так, например, весьма распространенные в природе минералы пироксены строятся из цепочек, составленных из тетраэдрических групп [SiO4]-(Рис.1.6.2.3.). В пироксенах тетраэдры соединяются друг с другом в «бесконечные» цепочки, используя для этого по две своихвершины - атомы кислорода,

Рис.1.6.2.3. Структура с цепочечными группами ковалентно- ионной связи в энстатите Mg2[Si2O6] и формы его кристаллов.
причем каждый из этих атомов кислорода становится общим для двух соседних тетраэдров. На рис.1.6.2.3. видно, что цепочка получается за счет повторения простейшего ее «звена», имеющего состав SiO3.
В гетеродесмических соединениях со слоистыми группами имеются группировки атомов, составляющих «бесконечные» слои, внутри которых связи одни, а между слоями другие. По типам связи среди них прежде всего выделяются минералы с ковалентными связями в пределах слоев и с молекулярными между слоями. Так обстоит дело в графите (Рис.1.6.2.4.), где атомы углерода соединяются в слой,


Рис. 1.6.2.4.. Строение кристаллической решетки графита и форма его кристалла.
используя свои четыре ковалентности, которые в противоположность алмазу направляются не строго по вершинам правильного тетраэдра. Каждый графитовый слой является по существу «бесконечной» плоскостной молекулой, а между слоями действуют слабые молекулярные связи. Поэтому графит относится к наиболее мягким минералам. Существуют также слоистые соединения, в которых действуют ковалентные и ионные связи. Весьма популярный минерал мусковит относится как раз к таким соединениям (Рис.1.6.2.5.), как и

Рис. 1.6.2.5. Кристаллическая структура мусковита на основе ковалентно-ионной связи и формы кристаллов слюды.
ряд других минералов. Его устройство очень громоздко. В мусковите имеются многоэтажные, очень сложно устроенные алюмосиликатные слои атомов, соединяющихся друг с другом отчасти ковалентными, отчасти ионными связями. Каждый слой представляется как плоский «бесконечно» протяженный, отрицательно заряженный ион. Такие слои — анионы соединяются в общую структуру посредством катионов однозарядного калия К+1. Структура мусковита определяет его исключительно высокие электроизоляционные свойства.
Аналогично соединениям с островными группами среди слоистых минералов также есть представители с тремя типами связи: ковалентной, ионной и молекулярной.
Гетеродесмические соединения с каркасными группами. По характеру связей среди них имеются только два типа. Гетеродесмические каркасные соединения с ковалентными и ионными связями достаточно часты, к ним, в частности, относятся такие важные породообразующие минералы, как полевые шпаты. Во всех соединениях такого рода имеется алюмосиликатный трехмерный каркас, получающийся за счет пространственного распределения ковалентных и ионных связей между атомами в составе каркаса, но не насыщенных целиком. Такой заряженный каркас способен присоединять дополнительные ионы, включая их в полости среди структуры каркаса.  В полевых шпатах, например в микроклине (рис.1.6.2.6.), каркас сооружается из атомов Si и Аl, в которых
В полевых шпатах, например в микроклине (рис.1.6.2.6.), каркас сооружается из атомов Si и Аl, в которых

Рис.1.6.2.6. Кристаллическая структура микроклина (гетеродесмическое соединение с каркасными группами) и формы кристаллов полевых шпатов.
связи направлены пространственно - по вершинам тетраэдра, и 0. Каркас это гигантский анион. Ввиду того, что каркасная постройка оказывается «рыхлой» и в ней наблюдаются значительной величины полости, в структуру могут входить для компенсации ее зарядов какие-либо крупные катионы, в одних полевых шпатах это K+1 в других – Na+1, в третьих – Ca+2, иногда Ba+2. Минералы с гетеродесмическими типами соединения атомов способны легко разрушаться по различным направлениям, имеют неустойчивые в разных направлениях свойства, могут включать в свою структуру большое количество посторонних примесей и др. Особенно важно это учитывать при анализе флотационных и сорбционных процессов, оценке твердости и др.
1.6.3.Мезодесмические соединения, как показывает их название (греч.) являются соединениями промежуточного характера между гомодесмичеокими и гетеродеомическими. Это означает, что в мезодесмических соединениях имеются промежуточные связи с различными и дробными соотношениями ионной, ковалентной, металлической и молекулярной связей и что в кристаллической структуре минералов выделяются несколько обособленные группировки атомов.
1.6.4.Некристаллические соединения. Некоторые минералы не получают при образовании кристаллической структуры, а другие даже возникают путем разрушения ранее бывшего кристаллического вещества. Поскольку такие минералы по этой причине не приобретают формы кристаллов, они получили в свое время название «аморфных» тел. Однако, термин этот вопреки его буквальному смыслу не следует относить к их форме, так -как любые минералы есть тела, а тел без формы не бывает; речь идет лишь об отсутствии кристаллографической формы и о некристаллической структуре. При образовании аморфных минералов сказывается влияние других формообразующих факторов - поверхностного натяжения и симметрии среды, почему в форме таких тел также замечаются определенные закономерности, еще слабо изученные.
Аморфные минералы также характеризуются химическим составом и структурой. Как и кристаллические минералы, они могут состоять непосредственно из атомов или простых ионов или они составляются из некоторых группировок атомов— молекул и сложных ионов разного состава, строения, формы и размера. Их специфика заключается в несимметричности общей структуры. Точнее говоря, в структуре «аморфных» минералов все же имеется некоторая статически проявляющаяся тенденция к правильному расположению составных частиц, обусловленная формой и расположением связей В отдельных участках таких тел иногда обнаруживаются даже элементы кристаллической структуры(Рис.1.6.4.1.), как, например, в аморфном опале SiO2+nH2O фиксируется отчасти проявленная структура кубического кристобалита p=SiO2.
 Рис. 1.6.4.1. Схема некристаллического соединения с каркасной структурой, составленной из кремнекислородных группировок, среди которых имеются полости разного размера.
Рис. 1.6.4.1. Схема некристаллического соединения с каркасной структурой, составленной из кремнекислородных группировок, среди которых имеются полости разного размера.
Намечается существование следующих типов аморфных минералов. К первому типу относятся аморфные минералы, состоящие из молекул. Примером служит аморфная сера, известная как минерал под названием сульфурит. Другой тип аморфных минералов характеризуется на примере уже упомянутого опала SiO2+nH2O. Основу этого минерала составляет непрерывный каркас из атомов кремния и кислорода. Третий, последний, из упоминаемых здесь типов такого рода минералов мог бы иллюстрироваться примерами вулканических стекол — минеральных соединений сложного и переменного состава, но их принято считать объектами не минералогии, а петрографии.
Рассмотренные типы кристаллохимических соединений минералов показывают, что среди них есть структуры «плотные» и «рыхлые», «цепочечные» и «листоватые», «сетчатые» и «изометрические». Многие из них имеют ослабленные направления связей между атомами и группами атомов, а также «дыры» в структуре, в которых уже находятся какие-то атомы, слабо связанные со структурой. Таким образом разные минералы готовы по разному реагировать с внешним воздействием. Одни готовы сопротивляться, другие – легко взаимодействовать. Технологу важно знать какими структурами обладают минералы, участвующие в том или ином процессе. В целом можно сказать, что структура минерала определяет такие свойства как способность раскалываться по определенным направлениям, химическую активность, способность к адсорбции, гидрофобность и гидрофильность, химический состав, теплопроводность и электропроводность.