Химия
Класс
Тема: Практическая работа № 4. Определение массовой доли
Растворенного вещества.
Практическая работа № 4.
Тема: Определение массовой доли растворенного вещества.
Цель: Научиться определять массовую долю растворенного вещества.
С растворами мы сталкиваемся регулярно, причём не только в химии, но и в обычной жизни. Например, чай с сахаром – самый что ни на есть раствор. Строго говоря, даже обычная вода, текущая из крана, – это раствор, потому что в ней растворены различные соли (загляните в чайник и убедитесь, что на стенках есть накипь. Это и есть соли, которые осели на стенках из воды). Растворы бывают концентрированными и разбавленными. В первых концентрация растворённого вещества велика (это когда вы в чашку чая насыпали 5 ложек сахара, во вторых – концентрация растворённого вещества мала (когда в чашу чая вы насыпали сахара совсем чуть-чуть). А вот характеристикой раствора является массовая доля растворённого вещества.
Массовая доля растворённого вещества в растворе – это отношение массы растворённого вещества к массе всего раствора.
Не забывайте, что масса раствора складывается из массы растворителя и растворённого вещества. Сразу разберём пример, чтобы стало понятно.
Ход работы
(Все пять примеров переписать в тетрадь)
Пример 1.
У нас есть 200 г воды и 10 г сахара. Смешиваем воду и сахар и получаем раствор. Так вот масса раствора будет равна массе воды (здесь это растворитель) и сахара (растворённое вещество), то есть 200+10=210 г. Это очень важно, не упускайте этот момент из виду.
Теперь возвратимся к массовой доле. Она обозначается латинской буквой w и рассчитывается по простой формуле:

При этом помните, что

Удобнее выражать массовую долю в процентах, поэтому чаще используется такая формула:
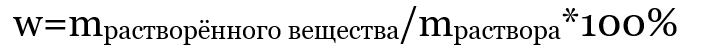
Массовая доля растворенного вещества: задачи
Чтобы уяснить чётко, что же такое массовая доля вещества в растворе, потренируемся решать задачи по химии.
Пример 2.
Смешали 150 г воды и 20 г хлорида натрия NaCl. Определите массовую доля хлорида натрия в полученном растворе.
Решение:
Сначала найдём массу раствора. Она складывается из массы воды и хлорида натрия, то есть 150+20=170 г. Это и есть масса раствора. Теперь ищем массовую долю NaCl:

Ответ: в полученном растворе массовая доля хлорида натрия составляет 11,7%.
Пример 3.
Известно, что в 250 г раствора нитрата калия содержится 10 г нитрата калия. Определите массовую долю нитрата калия.
Решение:
Обратите внимание, что в условии уже дана масса раствора, это существенно облегчает задачу, поскольку можно сразу использовать формулу для определения массовой доли:

Ответ: массовая доля нитрата калия в этом растворе 4%.
Пример 4.
В учебниках по химии встречаются и обратные задачи, когда массовая доля известна и требуется найти массу растворённого вещества или раствора. Например, условие звучит так. Нужно приготовить раствор серной кислоты в воде массой 200 г с массовой долей серной кислоты 64%. Сколько потребуется серной кислоты.
Решение:
Давайте разберёмся. У нас должно получиться 200 г раствора, то есть масса раствора 200 г. Массовая доля – 64%. Теперь воспользуемся формулой:

С нашими условиями получается так:
64=mН2SO4/200*100%
Отсюда получаем, что mН2SO4=64*200/100=128 г.
Ответ: для приготовления раствора потребуется 128 г серной кислоты.
Пример 5.
Необходимо приготовить раствор сульфата меди с массовой долей 8%. Масса сульфата меди 12 г. Какова будет масса полученного раствора?
Решение:
Сразу берём формулу

и подставляем данные из условия: wCuSO4=8%, mCuSO4=12 г, тогда
8=12/mраствора*100%
Отсюда mраствора=12/8*100=150 г.
Ответ: масса полученного раствора составит 150 г.
Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Домашнее задание:
Подготовиться к контрольной работе по теме «Растворы». В контрольной работе могут быть задачи подобные тем, что были в практической работе.