 I. Реакции с разрывом в карбоксильной группе связи O─H
I. Реакции с разрывом в карбоксильной группе связи O─H
1. Кислоты диссоциируют:
RCOOH ↔ RCOO−+ Н+
Водные растворы кислот изменяют окраску индикаторов, что издавна используется для качественного обнаружения кислот в растворах:
индикатор + Н+ (кислота) ↔ окрашенное соединение.
Индикаторы – это вещества сложного строения, которые ускоряют химическую реакцию, но сами при этом не расходуются.
| Индикатор | Цвет индикатора в среде | ||
| Щелочной (pH > 7) | Нейтральной (pH = 7) | Кислой (pH < 7) | |
| Универсальная индикаторная бумага | Синий | Желтый | Красный |
| Лакмус | Синий | Фиолетовый | Красный |
| Фенолфталеин | Малиновый | Бесцветный | Бесцветный |
| Метиловый оранжевый | Желтый | Оранжевый | Розовый |
Карбоновые кислоты слабее неорганических, наиболее сильной из них является муравьиная. Все карбоновые кислоты - слабые электролиты. Дикарбоновые кислоты во многом сходны с монокарбоновыми, однако являются более сильными. Например, щавелевая кислота сильнее уксусной почти в 200 раз. Дикарбоновые кислоты ведут себя как двухосновные и образуют два ряда солей - кислые и средние. Сила кислот уменьшается с увеличением числа атомов водорода в углеводородном радикале (из-за снижения полярности связи O-H); напротив, введение атомов галогена в углеводородный радикал приводит к возрастанию силы кислоты:
НСООН ← СН3СООН ← C2H6COOH ←...
| CH3COOH | 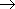
| CH2ClCOOH | 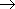
| CHCl2COOH | 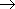
| CCl3COOH |
| уксусная кислота | монохлоруксусная кислота | дихлоруксусная кислота | трихлоруксусная кислота |
2. Образование солей.
а) Взаимодействуют с некоторыми металлами, стоящими в ряду напряжения металлов до водорода, с образованием соли и выделением водорода:
2СН3–СООН + Ва → (СН3– СОО)2Ва + Н2↑
уксусная кислота ацетат бария
б) Взаимодействуют с основными и амфотерными оксидами с образованием соли и воды:
2СН3–СООН + СаО → (СН3– СОО)2Са + Н2О,
2СН3– СООН + ZnО → (СН3–СОО)2Zn + Н2О.
в) Взаимодействуют с растворимыми и нерастворимыми основными (основаниями) и амфотерными гидроксидами с образованием соли и воды – реакция нейтрализации.
СН3–СООН + КОН → СН3–СООК + НОH,
2СН3–СООН + Zn(ОH)2 → (СН3–СОО)2Zn + 2НОH.
г) Взаимодействуют с солями более слабых и летучих кислот:
СН3–СООН + NaНСО3 → СО2↑ + Н2О + СН3–СООNa,
гидрокарбонат натрия ацетат натрия
СН3–СООН + СН3CH2CH2CH2–СООNa → СН3–СООК + СН3CH2CH2CH2–СООH.
пентанат натрия пентановая кислота
д) Взаимодействуют с аммиаком NH3 и гидроксидом аммония NH4OH:
СН3–СООН + NH3 → СН3–СООNH4,
ацетат аммония
СН3–СООН + NH4OH → СН3–СООNH4 + НОH.
ацетат аммония
 II. Реакции с разрывом связи C─O (замещение OH-группы).
II. Реакции с разрывом связи C─O (замещение OH-группы).
1. Взаимодействуют со спиртами с образованием сложных эфиров – реакция этерефикации:
СН3–СО−ОH + НО−СН3 ↔ CН3−СОО−СН3 + Н−ОH.
метиловый эфир уксусной кислоты
(метилацетат)
2. Взаимодействуют с аммиаком с образованием амидов кислот (через стадию образования аммонийной соли, с последующим нагреванием):
СН3–СООН + NH3 → СН3–СООNH4 → СН3–СОNH2 + Н2О.
уксусная кислота ацетат аммония ацетамид
3. Межмолекулярная дегидротация с образованием ангидридов.
СН3–СО−ОН + НО−ОС – СН3 → СН3–СО–O−ОС–СН3 + Н−ОH.
уксусная кислота ангидрид уксусной кислоты
4. Взаимодействуют с галогенидами фосфора (PCl5, PCl3) с образованием галогенангидридов карбоновых кислот:
СН3–СО−ОН + PCl5 → СН3–СО−Cl + POCl3 + HCl,
ацетилхлорид
3СН3–СН2–СООН + РСl3 → 3СН3–СН2–СОСl + Н3РО3.
пропилхлорид
5. Взаимодействуют с тионилхлоридом (SOCl2) с образованием галогенангидридов карбоновых кислот:
СН3–СО−ОН + SOCl2 → СН3–СО−Cl + SO2↑ + HCl
ацетилхлорид
III. Реакции по углеводородному радикалу.
 1. Реакции с разрывом связей C─H у α -углеродного атома углеводородного радикала – галогенирование:
1. Реакции с разрывом связей C─H у α -углеродного атома углеводородного радикала – галогенирование:
H─СН2–СООН + Cl2 → Cl─СН2–СООК + Н─Cl
СН3–СООН → ClСН2–СООН → Cl2СН–СООН → Cl3СН–СООН
уксусная хлоруксусная дихлоруксусная трихлоруксусная
кислота кислота кислота кислота
 |
Сила кислот усиливается
2. Реакции присоединения по месту разрыва непредельной π-связи в непредельных карбоновых кислотах:
а) гидрирование с получением предельных карбоновых кислот:
С8Н17─CH=CH─C7H15–СООН + H2 → С8Н17─CH2─CH2─C7H15–СООН
олеиновая кислота стеариновая кислота
б) галогенирование с получением дигалогенпроизводных карбоновых кислот:
С8Н17─CH=CH─C7H15–СООН + Cl2 → С8Н17─ClCH─ClCH─C7H15–СООН
олеиновая кислота 9, 10-дихлорстеариновая кислота
IV. Реакции окисления для карбоновых кислот.
1. Горение карбоновых кислот:
CH3COOH + 2O2 → 2CO2↑ + 2H2O
IV. Особые свойства муравьиной кислоты.
Так как в молекуле муравьиной кислоты содержится как карбоксильная группа, так и альдегидная группа –
| O // H–C \ OH | O // H–C \ OH |
Она обладает всеми свойствами предельных одноосновных карбоновых кислот, так и свойствами альдегидов, например, реакции окисления:
H─CO─OH + [O] → HO─CO─OH (т.е. H2CO3) → CO2↑ + H2O
а) при реакции «серебрянного зеркала» - взаимодействие с аммиачным раствором оксида серебра (I):
HCOOH + Ag2O (аммиачный раствор) → CO2↑ + H2O + 2Ag↓ (при нагревании)
(HCOOH + 2Ag(NH3)2OH (аммиачный раствор) → CO2↑ + H2O + 2Ag↓ + 4NH3↑)
б) при взаимодействии со свежеприготовленным раствором гидроксида меди(II):
HCOOH + 2Cu+2(OH)2↓ → CO2↑ + H2O + Cu2+O↓ (при нагревании)
в) Кроме того, при нагревании с концентрированной H2SO4 муравьиная кислота разлагается на оксид углерода (II) и воду:
HCOOH → CO↑ + HOH.
Вопросы: (для контроля знаний)
- Какие вещества относятся к карбоновым кислотам и как образуются названия их соединений?
- Какие виды изомерии характерны для карбоновых кислот? Приведите примеры.
- Как изменяются свойства карбоновых кислот с увеличением количества атомов углерода, их основности (числа карбоксильных групп) или введения в углеводородный радикал атомов галогенов?
- При помощи каких реакций можно показать генетическую связь карбоновых кислот с другими классами органической химии?
- Какие химические реакции характерны для карбоновых кислот? Приведите уравнения реакций.
Список используемых источников:
- О.С. Габриелян и др. Химия. 10 класс. Профильный уровень: учебник для общеобразовательных учрждений; Дрофа, Москва, 2005г.
- «Репетитор по химии» под редакцией А. С. Егорова; «Феникс», Ростов-на-Дону, 2006г.
- https://sovety-tut.ru/uroki-himii/karbonovyie-kislotyi-metodyi-polucheniya-i-svoystva
- https://examchemistry.com/content/lesson/orgveshestva/karbonovyekty.html
- https://www.yaklass.ru/materiali?mode=lsntheme&themeid=142
- https://www.calc.ru/Karbonovyye-Kisloty.html