Ферменты бывают простые и сложные.
Простые ферменты - это такие ферменты, которые состоят только из аминокислот, т.е имеют исключительно белковую природу.
Сложные ферменты — это ферменты, которые помимо белковой части (апофермента) имеют еще и небелковую часть — КОФАКТОР.
Какие вещества могут быть КОФАКТОРАМИ?
· Коферменты — это различные производные витаминов, нуклеотиды… (коферменты и нужны для того, чтобы образовывать активный центр. Ну и улучшать связывание субстрата с ферментом.)
· Ионы металлов — железо, цинк и т.д
PS: иногда кофакторы называют коферментами
1. Строение фермента:
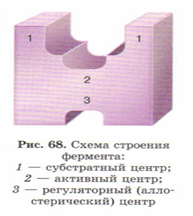
1) Субстратный центр - “площадка”, на которой субстрат соединяется и удерживается связями с ферментом.
2) Активная часть - место, где происходит реакция.
Активный и субстратный центр совпадают или находятся рядом.
3) Регуляторный (аллостерический) центр - место присоединения молекул, которые изменяют конформацию фермента и делают его активный центр доступным/недоступным для реакции.
К регуляторному центру присоединяются молекулы, снижающие активность фермента и повышающие активность фермента.
Специфичность
Ферменты обладают высокой специфичностью. Э.Фишер, немецкий химик, сказал, что “субстрат подходит к ферменту как ключ к замку”.
Что это значит? Фермент способен катализировать только одну определенную реакцию, направленную на один вид связи в молекуле.
Ферменты имеют один или несколько похожих субстратов.
На этом основано действие многих лекарственных препаратов - похожие субстраты связываются с активным центром, делая его недоступным для истинных субстратов фермента.
3. Механизм действия фермента:
|
|
1. Соединение фермента и субстрата в субстратном центре.
2. Образование комплекса фермент-субстрат.
3. Химическая реакция в активном центре.
4. Образование комплекса фермент-продукты.
5. 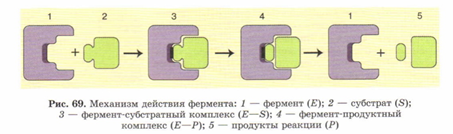 Распад (диссоциация) комплекса с высвобождением одного или нескольких продуктов и освобождением фермента.
Распад (диссоциация) комплекса с высвобождением одного или нескольких продуктов и освобождением фермента.
Факторы, влияющие на скорость реакции
1) Концентрация фермента

Прямая зависимость: чем больше фермента, тем быстрее идет реакция.
Больше мест, чтобы присоединиться к активному центру
Пример из жизни: чем больше окон работают в отделении Почты, тем быстрее проходит очередь.
2) Концентрация субстрата
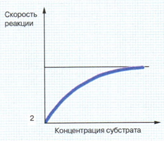 При постоянной концентрации фермента:
При постоянной концентрации фермента:
1) происходит постепенное насыщение ферментов субстратом - скорость увеличивается,
2) при максимальном насыщении повышение концентрации субстрата не вызывает увеличения скорости, так как нет “вакантного” места, чтобы присоединиться к ферменту. При этом скорость реакции остается максимальной.
Пример из жизни: если на той же почте работает всё то же количество окон, то от увеличения количества людей в очереди никто работать быстрее не станет.
3) Температура
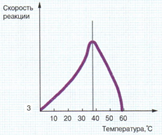 Повышение температуры вызывает повышение частоты столкновений молекул фермента и субстрата - скорость растет.
Повышение температуры вызывает повышение частоты столкновений молекул фермента и субстрата - скорость растет.
Однако превышение оптимума температуры (у человека 38 градусов) приводит к денатурации ферментов и снижению скорости ферментативной реакции.
4) рН среды
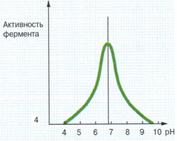 Изменение оптимального рН среды для конкретного фермента приводит к изменению его конформации и денатурации, что снижает скорость реакции.
Изменение оптимального рН среды для конкретного фермента приводит к изменению его конформации и денатурации, что снижает скорость реакции.
|
|
В основном ферменты работают в нейтральной среде, но некоторые ферменты требуют особых условий, например, ферменты желудочного сока работают при низких значениях рН (кислая среда).