Определение валентности по химическим формулам соединений
Для бинарных соединений, т. е. образованных двумя элементами типа  (где а, b — индексы; х, у — валентности), произведение индекса на валентность одного элемента равно произведению индекса на валентность другого элемента. Здесь соблюдается равенство ах = by. Поэтому, если три величины (скажем, а, b, х) известны, то можно найти четвертую: у = ах/b.
(где а, b — индексы; х, у — валентности), произведение индекса на валентность одного элемента равно произведению индекса на валентность другого элемента. Здесь соблюдается равенство ах = by. Поэтому, если три величины (скажем, а, b, х) известны, то можно найти четвертую: у = ах/b.
Если в формуле бинарного соединения нет индексов, то валентности элементов одинаковые. Зная валентность одного элемента, можно написать валентность другого, например: 
Если валентность одного элемента равна единице, то валентность другого элемента равна индексу при одновалентном элементе, например: 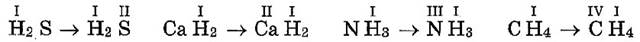
Определение возможной валентности элемента по его положению в таблице Менделеева
1. Максимальная или высшая валентность элемента часто равна номеру группы таблицы Менделеева, в которой расположен элемент. (Группы элементов — это вертикальные столбцы в таблице.) Например, высшие валентности некоторых элементов следующие: Si(IV), P(V), S(VI), Cl(VII).
2. У элементов V—VII групп в дополнение к высшей валентности, равной номеру группы, бывает другая валентность, представляющая разность: 8 — № группы, т. е. у фосфора Р(III), у серы S(II), у хлора Сl(I). Как правило, это низшая валентность.
Чтобы составить химическую формулу бинарного соединения, надо знать последовательность элементов в формуле (какой элемент первый) и их валентность.
Правила очередности элементов в формул е и проявляемая валентность следующие.
· 1) Первым записывают металл, за ним — неметалл: FeO, AI2O3, Cu2S.
· 2) Если в формуле одни неметаллы, то сначала пишут символ элемента, расположенного в таблице Менделеева левее и ниже: NO2, РСl5, CS2, НСl, SiF4, PBr3.
· 3) Обычно 1-й элемент в формуле бинарного соединения проявляет свою высшую (или большую) валентность, а 2-й элемент проявляет низшую валентность

Примеры определения валентности
Пример 1. Составьте формулу соединения (т.е. вещества) алюминия с кислородом (оксида алюминия).
Решение. Алюминий — металл, поэтому он 1-й в формуле: Аl а О b. Валентности кислорода (II) и алюминия (III) — постоянные, следовательно, вид формулы:
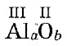
Минимальные целые числа, удовлетворяющие равенству а • III = b • II, это а = 2, b = 3. Здесь валентность одного элемента равна индексу при другом элементе, х = b, у = а. Следовательно, искомая формула: Аl2O3.
Пример 2. Составьте формулу соединения серы с кислородом при условии, что сера проявляет свою высшую валентность.
Решение. Сера и кислород — неметаллы. В таблице Менделеева сера находится ниже кислорода, она 1-я в формуле S a O b. Высшая валентность серы равна номеру ее группы (VI) в таблице Менделеева: 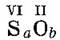
Минимальные целые числа, удовлетворяющие равенству а • VI = b • II, это а = 1, b = 3. Здесь валентность одного элемента не равна индексу при другом элементе, х ≠ b, у ≠ а. Искомая формула: SO3.
Пример 3. Составьте формулу соединения серы с фосфором, в котором валентность фосфора — V.
Решение. Оба элемента S и Р — неметаллы. Первым в формуле записываем фосфор, так как он находится левее, чем сера, в таблице Менделеева: P a S b.
Валентность фосфора P(V) указана в задании. Сера (2-й элемент в формуле) проявляет свою низшую валентность S(II). Чтобы удовлетворялось равенство ах = by для соединения 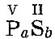 , индексы должны быть а = 2, b = 5. Искомая формула: P2S5.
, индексы должны быть а = 2, b = 5. Искомая формула: P2S5.
Пример 4. Составьте химические формулы бинарных соединений с кислородом (оксидов) следующих элементов: a) Li; б) Са; в) Sn(IV); г) С(II); д) Р(III); е) P(V).
Решение. Во всех этих формулах кислород — 2-й в формуле. Там, где валентности элементов нечетные, индекс при кислороде равен валентности соответствующего элемента, а индекс при элементе равен двум — валентности кислорода. В формулах оксидов веществ б) и г) индексов нет, т.к. валентности элементов одинаковые и равны II. В формуле оксида олова, чтобы суммарная валентность кислорода равнялась валентности олова, пишем при кислороде индекс «2». Формулы оксидов:
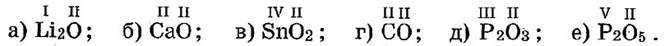
Конспект урока «Определение валентности на примерах».