Методические указания
Закон эквивалентов открыт в конце 18 века: вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам. Для решения задач удобно пользоваться другой формулировкой: массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам)


 - количество эквивалентов
- количество эквивалентов  - количество эквивалентов
- количество эквивалентов
Химическим эквивалентом элемента (молярной массой эквивалента) называется такое его количество (моль), которое соответствует 1 моль атомов водорода (соединятся с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях). Химический эквивалент не является постоянной величиной, он зависит от валентности (степени окисления) элемента.
Молярная масса эквивалента (мэ) – это масса одного эквивалента (грамм/моль*экв, килограмм/моль*экв). Молярная масса эквивалента равна частному от деления молярной массы его атомов (А) на валентность (степень окисления) элемента (В) в данном соединении:
МЭ=А/В
Например, молярная масса эквивалента серы в SO2 и SO3 соответственно равны 32/4 = 8 г/моль и 32/6 = 5.33 г/моль.
Эквивалентным объемом (л/моль, м3/моль) называется объем, занимаемый при данных условиях (Р, Т) 1 эквивалентов вещества. Значения эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что в молярном объеме любого газа, состоящего из одноатомных молекул, содержится 2 моля атомов и т.д. Так в 22.4 л Н2 содержится при нормальных условиях (Р0=760 мм рт.ст.=101325 Па; Т0 = 273 К) 2 моля атомов водорода. Поскольку эквивалент водорода равен 1 моль, то в 22.4 л Н2 содержится 2 эквивалента водорода; значит, эквивалентный объем водорода равен
22.4/2 = 11.2 л/моль = 11.2 * 10-3 м3/моль.
Пример № 1. Определить эквивалента и эквивалентные массы элементов в соединениях HF, H2O, NH3, CH4.
Решение. В указанных соединениях с 1 моль атомов водорода соединяется 1 моль атомов фтора, 1/2 моль атомов кислорода, 1/3 моль атомов азота, 1/4 моль атомов углерода.
Следовательно, фактор эквивалентности фтора, кислорода, азота и углерода соответственно равны 1 моль, 1/2 моль, 1/3 моль, 1/4 моль. Исходя из молярных масс атомов этих элементов, определяем, молярную масса эквивалента фтора равна 19 г/моль, кислорода – 16 * 1/2 = 8 г/моль, азота – 14 * 1/3=4.67 г/моль, углерода – 12 * 1/4=3 г/моль.
Для определения молярной массы эквивалента не обязательно исходить из его соединения с водородом. Молярную массу эквивалента можно вычислить по составу соединения данного элемента с любым другим, молярная масса эквивалента которого известна.
Пример № 2. Вычислить молярную массу эквивалента металла, зная, что его хлорид содержит 79.78% хлора. Молярная масса эквивалента хлора равна 35.45 г/моль•экв.
Решение. Содержание металла в этом соединении составляет: 100 – 79.78=20.22%. Согласно закону эквивалентов: количество эквивалентов металла равно количеству эквивалентов хлора mме/ Мэ ме = mСl/ Мэ Сl, т.е.
20.22/ Мэ ме = 79,78/35.45 => Мэ ме=20.22•35.45/79.78=8.98 г/моль. Молярная масса эквивалента металла равена 8.99 г/моль.
Молярные массы эквивалентов химических соединений так же как молярные массы эквивалентов элементов могут иметь переменные значения. Это определяется характером превращения веществ.
Молярные массы эквивалентов оксидов в реакциях обмена:

где Моксида – молярная масса оксида; n – число атомов элемента;
В – валентность (степень окисления) элемента.
Пример № 3. Определить эквивалентные массы оксидов железа.
Решение. Железо образует три оксида FeO, Fe2O3, FeO3.
Мэ FeO = 71/(2*1) = 35.5 (г/моль); Мэ Fe2O3=159.6/(2*3) = 26.6 (г/моль);
Мэ FeO3= 103.8/(6*1) = 16.3 (г/моль)
Молярные массы эквивалентов кислот в реакциях обмена:

где Мкислоты – молярная масса кислоты; nн – число атомов водорода, содержащихся в молекуле кислоты, способных замещаться на металл.
Пример№4. Определить молярную массу эквивалента и фактор эквивалентности H3PO4 в следующих реакциях:
1) H3PO4 + 3KOH = K3PO4 + 3H20;
2) H3PO4 + 2KOH = K2HPO4 + 2H20;
3) H3PO4 + KOH = KH2PO4 + H20;
Решение. Молярная масса H3PO4 равна 98 г/моль.
В реакции (1) количество nн атомов водорода, заместившихся на металл, равно 3, следовательно эквивалент Н3Р04 равен 1/3 моль, а эквивалентная масса ЭН3Р04 = 98/3 = 32.7 (г/моль).
В реакции (2) пн-2, следовательно, эквивалент Н3Р04 равен 1/2 моль, а эквивалентная масса Э = 98/2 = 49 (г/моль).
В реакции (3) пн= 1, следовательно, эквивалент Н3Р04 равен 1 моль, а эквивалентная масса Э = 98/1 = 98 (г/моль).
Молярные массы эквивалентов оснований в реакциях обмена:

где Mоснования – молярная масса основания; nон – валентность металла ли число гидроксильных групп в молекуле основания, способных заместиться на кислотный остаток.
Пример № 5. Определить молярную массу эквивалента и фактор эквивалентности Сu(ОН)2 в следующих реакциях:
1) Сu(ОН)2 + 2HCl = CuCl2 + 2H2O;
2) Сu(ОН)2 + HCl = CuOHCl + H2O;
Решение. Молярная масса Сu(ОН)2 равна 97.5 г/моль. В реакции (1) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 2, следовательно фактор эквивалентности Сu(ОН)2 равен 1/2 моль, а молярная масса эквивалента МэСu(ОН)2 = 97.5/2 = 48.75 (г/моль).
В реакции (2) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 1, следовательно эквивалент Сu(ОН)2 равен 1 моль, а эквивалентная масса ЭСu(ОН)2 = 97.5/1 = 97.5(г/моль).
Эквиваленты солей в реакциях обмена:
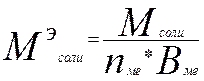
где Мсоли – молярная масса соли; – число атомов металла; – валентность (степень окисления) металла.
Пример № 6. Определить молярную массу эквивалента сульфата алюминия.
Решение. Молярная масса сульфата алюминия Al(SO4)3 равна 342 г/моль. Следовательно, МэAl2(SO4)3 = 342/(2•3) = 57 г/моль.
Окислительно-восстановительные эквиваленты определяются путём деления молярной массы на число электронов, идущих на восстановление или окисление
Мэо(в) = Мо(в)/nе
где Мо(в) – молярная масса окислителя (восстановителя); nе – число электронов, идущих на окисление (восстановление).
Пример № 7. Чему равна молярная масса эквивалентна перманганата калия как окислителя, если это вещество в процессе реакции восстанавливается: 1) до сульфата марганца; 2) до диоксида марганца; 3) манганата калия?
Решение. 1) При восстановлении KMnO4 до MnSO4 степень окисления марганца понизится с +7 до +2, т.е. число электронов, идущих на восстановление, равно 5. Следовательно,
МэKMnO4 = MKMnO4/5 = 158/5 = 31.6 (г/моль).
2) При восстановлении KMnO4 до MnO2 степень окисления марганца понизится с +7 до +4, т.е. число электронов, идущих на восстановление, равно 3. Следовательно,
МэKMnO4 = MKMnO4/3 = 158/3 = 52.66 (г/моль).
3) При восстановлении KMnO4 до K2MnO4 степень окисления марганца понизится с +7 до +6, т.е. число электронов, идущих на восстановление, равно 1. Следовательно,
МэKMnO4 = MKMnO4/1 = 158/1 = 158 (г/моль).
Выполнение работы
Определение эквивалентной массы металла
Задание: Определить экспериментально эквивалентную массу металла (магния, цинка – по заданию преподавателя) по количеству выделившегося водорода в реакции взаимодействия металла с соляной кислотой
Ме +2HCl = МеCl2+H2
Вычислить ее теоретическое значение и относительную ошибку эксперимента.
Приборы и реактивы. Прибор для определения эквивалента металла (рис.1.1.). Аналитические весы. Термометр. Барометр. Мерный цилиндр на 25-50 мл. Стаканчик химический. Фильтровальная бумага. Навеска металла (химически чистого) около 0.04 – 0.05 г. Соляная кислота (10мас.% раствор).
Ход определения.
1. Налить через воронку в бюретку воду до нулевого деления. Плотно закрыть отверстие бюретки пробкой со стеклянной трубкой. В одну часть сосуда Ландольта поместить навеску цинка. Другую часть сосуда через воронку наполнить на две трети объема разбавленной (10мас.%) соляной кислотой. Присоединить сосуд к свободному концу трубки, соединенной с бюреткой.
2. Проверить герметичность прибора. Для этого опустить или поднять воронку вместе с кольцом на 10-15 см. Если уровень воды в бюретке не меняется, то прибор герметичен и можно приступать к опыту. Если уровень воды в бюретке меняется, то необходимо плотнее закрыть пробками бюретку и сосуд, снова проверить и т.д. Уровень воды V1 в бюретке до начала опыта записать с точностью до 0.1 мл.
3. Привести в контакт кислоту и металл, осторожно наклоняя сосуд Ландольта. После полного растворения металла выждать 5-7мин., чтобы содержимое сосуда охладилось. Затем установить на одной высоте уровень воды в бюретке и воронке. При этом внутри прибора создается давление, равное давлению наружного воздуха. Записать уровень воды V2 в бюретке после опыта.
4. Результаты эксперимента внести в журнал по форме:
Навеска металла, m, г……………………………………………………..
Уровень воды в бюретке:
до опыта V1, мл………………………………………...….....
после опыта V2, мл…………………………………………..
Объем выделившегося водорода VН2, мл………………………………..
Объем водорода при нормальных условиях (н.у.) V0, мл………………
Температура опыта T = 273+t, K…………………………………………
Барометрическое давление P, мм рт.ст…………………………………..
Давление насыщенного водяного пара h, мм рт.ст. при температуре опыта……………………………………………………
Экспериментальная эквивалентная масса металла Мээксп, г/моль……….
Теоретическая эквивалентная масса металла Мэ теор, г/моль……………..
Относительная ошибка e, %.........................................................................
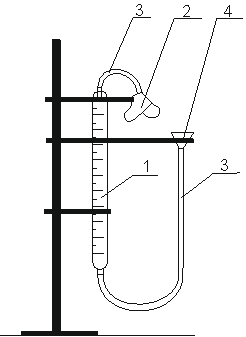
Рис. 1.1. Прибор для определения эквивалента металла:
1) Бюретка для измерения объёма выделившегося водорода;
2) Сосуд Ландольта для проведения реакции;
3) Каучуковая трубка;
4) Воронка.
Вычисления:
1. Подсчитать VН2, вытесненного водорода по разности уровней в бюретке:
VН2 = V2-V1
2. Привести это объем к нормальным условиям:

Величину h посмотреть в справочнике. Поправку h вводят вследствие того, что общее давление на воду является суммой пропорциональных давлений водорода и воды.
3. Вычислить экспериментальную массу металла:
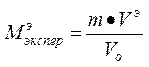
где - эквивалентный объем водорода, равный 11200 мл/моль.
4. Сравнить найденную экспериментальную эквивалентную массу металла с теоретически посчитанным Этеор = А/В, вычислив в процентах ошибку опыта:

3. Контрольные вопросы и задачи
1. Вычислить молярные массы эквивалентов следующих элементов:
а) магния, если известно, что при нагревании одного моль его в токе кислорода, масса увеличилась на 66.7%. Ответ: 11.9 г/моль;
б) олова, если при нагревании 0.9185 г его в токе кислорода образуется 1.166 г оксида олова. Ответ: 29.68 г/моль.
2. Определить молярную массу эквивалента элемента, если при восстановлении 1.3 г оксида этого элемента алюминием получилось 1.02г оксида алюминия, содержащего 47% кислорода. Ответ: 13.66г/моль.
3. Написать формулу соединения сурьмы с серой, если известно, что молярная масса атомов сурьмы равна 121.8 г/моль, эквивалентная масса ее - 40.6 г/моль, молярная масса атомов серы равна 32 г/моль, эквивалентная масса - 16 г/моль.
4. Определить молярные массы эквивалентов и факторы эквивалентности кислот и оснований в следующих реакциях:
а) HNO3 + Bi(OH)3 = Bi(0H)2NO3 + Н2O;
б) H2S + NaOH = NaHS + Н2O;
в) 3H2SO4 + 2А1(ОН)3 = Al(SO4)3 + 6H2O;
г) Н3РO4 + Са(ОН)2 = СаНРO4 + 2Н2O;
д) 2HCl + Bi(ОН)3 = ВiOНСl2 + Н20.
5. Вычислить молярную массу эквивалента и фактор эквивалентности хромата калия К2СrO4 как окислителя, если К2СrO4 восстанавливается до КСrO2.
6. Определить молярную массу эквивалента металла, если 0.34*10-3 кг его вытесняют из кислоты 56.94*10-6 м3 водорода при температуре 0°С и давлении 94643 Па. Ответ: 67.8 г/моль.
7. Определить молярную массу эквивалента металла в следующих соединениях:
Мn2O7, Мg2P2O7, Сr2O3, Ва(ОН)2, Аl2(SO4)3 * 18Н2O, Сa3(РO4)2, Аg2O, FeSO4 • 7H2O, СrРО4.
8. Чему равен эквивалентный объем кислорода?