Пример 1. Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при Т = 298 К двумя способами.
Решение. Выпишем из таблицы 1 приложения значения стандартных электродных потенциалов Zn и Ag:
 В,
В, 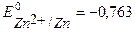 В.
В.
Т.к.  , электроны будут переходить от цинкового электрода к серебряному. Тогда серебряный электрод – катод, цинковый электрод – анод (уравнение 2.2). ТОР: (уравнение 2.3).
, электроны будут переходить от цинкового электрода к серебряному. Тогда серебряный электрод – катод, цинковый электрод – анод (уравнение 2.2). ТОР: (уравнение 2.3).
1 способ: рассчитаем 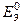 этого ГЭ по уравнению 2.1а:
этого ГЭ по уравнению 2.1а:
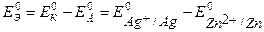 = 0,799 – (– 0,763) = 1,562 В
= 0,799 – (– 0,763) = 1,562 В
2 способ: по уравнению (2.6) рассчитываем
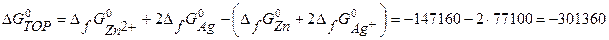 (Дж);
(Дж);
По уравнению 2.4: 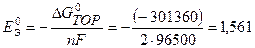 B.
B.
Значения 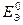 , рассчитанные первым и вторым способами, практически равны между собой.
, рассчитанные первым и вторым способами, практически равны между собой.
Пример 2. Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активности ионов Zn2+ и Ag+ равны между собой и составляют 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ и стандартная ЭДС элемента те же, что в примере 1.1. Рассчитаем величины электродных потенциалов.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов (уравнение 1.4 а):
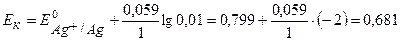 B.
B.
 B.
B.
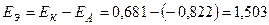 B.
B.
При одинаковой активности потенциалопределяющих ионов, согласно уравнению Нернста, изменение анодного потенциала меньше, чем катодного. ЭДС данного ГЭ меньше, чем стандартная ЭДС элемента.
Пример 3. Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.2.
Решение. Анодом ГЭ является цинковый электрод. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:
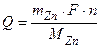
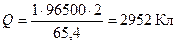
Максимально вырабатываемая электроэнергия 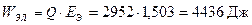 или Wэл = 1,23 Вт ч.
или Wэл = 1,23 Вт ч.
Пример 4. Рассчитайте ЭДС цинк-хлорного ГЭ, если  , и
, и 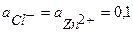 при Т = 298 К. Предложите способы увеличения ЭДС ГЭ.
при Т = 298 К. Предложите способы увеличения ЭДС ГЭ.
Решение. Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn2+ + 2 
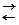 Zn:
Zn:
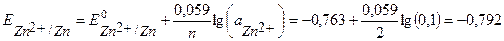 В.
В.
Для потенциалопределяющей реакции Cl2(газ) + 2 
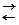 2Cl–(р)
2Cl–(р)
 В.
В.
Так как 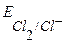 >
>  , то цинковый электрод – анод, хлорный электрод – катод, тогда уравнения электродных реакций и ТОР будут следующие:
, то цинковый электрод – анод, хлорный электрод – катод, тогда уравнения электродных реакций и ТОР будут следующие:
А-: Zn – 2  → Zn2+
→ Zn2+
К+: Cl2 + 2  → 2Cl–
→ 2Cl–
ТОР: Zn + Cl2 → Zn2+ + 2Cl–
Вычислим значения ЭДС ГЭ: 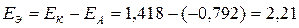 В.
В.
Увеличить ЭДС данного ГЭ можно, если:
– увеличить температуру;
– уменьшить активность ионов Zn2+;
– уменьшить активность ионов Cl– ;
– увеличить парциальное давление Cl2.
Пример.5. Рассчитайте ЭДС концентрационного ГЭ:
H2,Pt | НCl || СН3СООН| H2,Pt, работающего при одинаковых давлениях 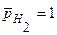
и одинаковых концентрациях водных растворов кислот c0 = 0,1 моль/л.
Решение. Для кислой среды уравнения электродных реакций в концентрационном элементе:
А -: H2 → 2H+ + 2 
К+: 2H+ + 2  → H2
→ H2
Величина равновесного потенциала этих электродов определяется по уравнению
 , при
, при 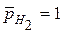 .
.
Рассчитаем активность ионов водорода 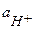 :
:
а) в растворе уксусной кислоты: СН3СООН 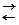 СН3СООН– + H+,
СН3СООН– + H+,
т.к. уксусная кислота является слабым электролитом, то коэффициент активности 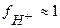 и
и 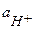 ≈
≈ 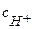 ; константа диссоциации Кд = 1,75 10-5
; константа диссоциации Кд = 1,75 10-5
 = αс 0, где степень диссоциации
= αс 0, где степень диссоциации 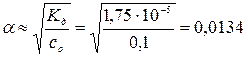 и тогда
и тогда

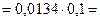
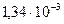 , следовательно
, следовательно 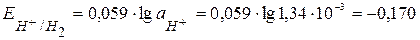 В.
В.
б) в растворе соляной кислоты: HCl → H+ + Cl–,
так как НСl является сильным электролитом, то сначала рассчитываем ионную силу раствора:
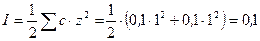 ,
,
затем по таблице находим коэффициент активности 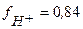 и тогда:
и тогда:
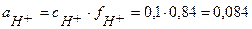 и
и 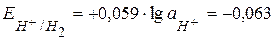 В.
В.
Т.к. 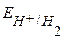 , рассчитанный для соляной кислоты больше, чем для уксусной, то катодом будет электрод погруженный в раствор соляной кислоты, анодом - электрод погруженный в раствор уксусной кислоты.
, рассчитанный для соляной кислоты больше, чем для уксусной, то катодом будет электрод погруженный в раствор соляной кислоты, анодом - электрод погруженный в раствор уксусной кислоты.
 В.
В.
Задачи по электролизу
Пример 1. Рассмотрите электролиз расплава соли хлорида лития LiCl на нерастворимых Pt-электродах. Рассчитайте минимальную разность потенциалов Umin электролиза. Напишите уравнения электродных процессов.
Решение. Запишем ионный состав электролита:
LiCl → Li+ + Cl-
и стандартные потенциалы электродных процессов:
К-:  B,
B,
A+ : 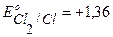 В.
В.
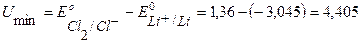 B.
B.
Электродные процессы:
K-: Li+ + 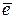 → Li
→ Li
A+: 2Cl- → Cl2 + 2 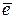 .
.
Данный электролиз можно использовать для получения лития и хлора.
Пример 2. Определите минимальную разность потенциалов Umin, которую необходимо подать на Pt-электроды для проведения электролиза водного раствора KOH, рН = 12. Напишите уравнения процессов электролиза. Рассчитайте объемы газов (приведенные к нормальным условиям), которые образуются на электродах за 10 часов при токе 5А.
Решение. Запишем уравнения диссоциации раствора электролита
КОН → К+ + ОН- ; H2O 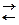 H+ + OH-
H+ + OH-
и определим равновесные потенциалы возможных электродных процессов:
К-: 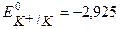 B,
B, 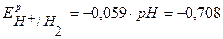 В,
В,
А+: 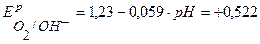 В.
В.
Так как Е0 К+/К значительно отрицательнее 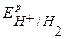 , то на катоде будет протекать только процесс восстановления ионов Н+, а на аноде – процесс окисления ионов ОН-:
, то на катоде будет протекать только процесс восстановления ионов Н+, а на аноде – процесс окисления ионов ОН-:
К-: 2Н2О + 2 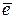 → Н2 + 2ОН-,
→ Н2 + 2ОН-,
А+: 4ОН- - 4 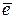 → О2 + 2Н2О.
→ О2 + 2Н2О.
Минимальная разность потенциалов для электролиза данного раствора:
 B.
B.
Объем газов, выделившихся на электродах, рассчитаем по закону Фарадея (условия нормальные):
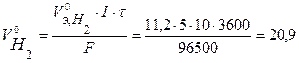 л,
л,
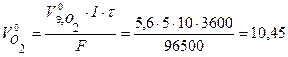 л.
л.
Электролиз водного раствора гидроксида калия широко применяется для электрохимического получения водорода.
Пример 3. Рассмотрите электролиз водного раствора CuCl2 на графитовых (нерастворимых) электродах. Напишите электродные процессы, покажите ход поляризационных кривых. Рассчитайте массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2.
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
CuCl2 → Cu2+ + 2Cl- H2O 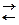 H+ + OH-.
H+ + OH-.
Соль CuCl2 образована слабым основанием Cu(OH)2 и сильной кислотой HCl, следовательно, при ее растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н+, раствор электролита будет иметь слабокислую реакцию среды (примем рН = 5).
Определим потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
К-: 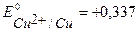 B,
B, 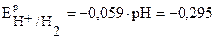 B,
B,
т.к. 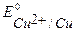 более положителен, чем
более положителен, чем 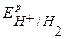 , то на катоде будет протекать только процесс восстановления ионов меди Сu2+ из раствора электролита.
, то на катоде будет протекать только процесс восстановления ионов меди Сu2+ из раствора электролита.
A+ : 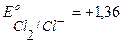 В,
В,  В,
В,
т.к. 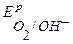 более отрицателен, чем
более отрицателен, чем  , то в первую очередь на аноде будет идти процесс окисления ионов ОН-. Однако, вследствие поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки, поэтому на аноде будет идти также процесс окисления ионов Cl– из раствора электролита. Таким образом, на электродах протекают следующие процессы:
, то в первую очередь на аноде будет идти процесс окисления ионов ОН-. Однако, вследствие поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки, поэтому на аноде будет идти также процесс окисления ионов Cl– из раствора электролита. Таким образом, на электродах протекают следующие процессы:
K-: Cu2+ + 2  → Cu
→ Cu
A+: 2H2O → O2 + 4H+ + 4 
2Cl- → Cl2 + 2  .
.
Электролиз данного раствора можно проводить для нанесения медного покрытия на изделие, а также для получения газообразных кислорода и хлора.
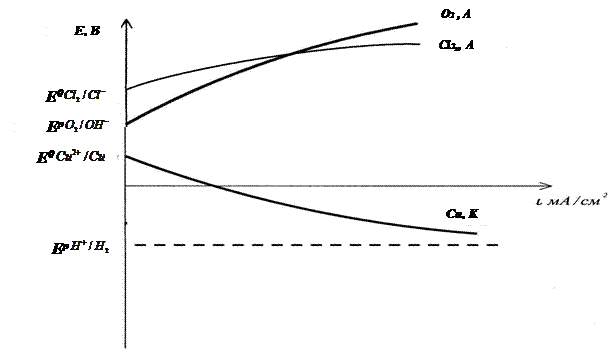 |
Рис. 3.2. Поляризационные кривые процесса электролиза водного раствора хлорида меди на нерастворимых электродах.
Определим массу меди, образовавшейся на катоде, для чего сначала рассчитаем объемы моль эквивалентов газов при н.у. и массу моля эквивалента меди:
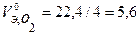 л/моль,
л/моль,  л/моль,
л/моль, 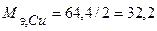 г/моль.
г/моль.
По закону Фарадея определим количество электричества, необходимое для выделения заданных объемов кислорода и хлора на аноде (н.у.):
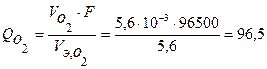 Кл,
Кл,
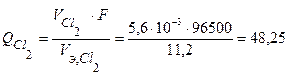 Кл.
Кл.
Суммарное количество электричества, прошедшее через анод, равно:
 Кл.
Кл.
Такое же количество электричества на катоде (Q К = Q А) пойдет только на один процесс образования меди. По закону Фарадея определим массу выделившейся меди:
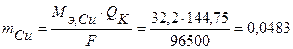 г = 48,3 мг
г = 48,3 мг
Определим выход по току (Bj) для всех процессов электролиза:
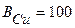 %, (т.к. на катоде идет один процесс);
%, (т.к. на катоде идет один процесс);
 %;
%; 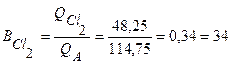 %.
%.
Пример 4. Рассмотрите электролиз водного раствора CuCl2 на медных электродах. Напишите уравнения электродных процессов, покажите ход поляризационных кривых. Чем отличается ход поляризационных кривых в данном варианте от варианта, рассмотренного в примере 3.3.?
Решение. Ионный состав раствора электролита таков же, как в примере 3.3., поэтому на катоде, как и в случае с электролизом на нерастворимых электродах, пойдет только процесс восстановления ионов меди. Потенциалы возможных процессов на аноде: 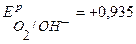 В,
В,  В, (см. пр. 3.3), потенциал материала анода
В, (см. пр. 3.3), потенциал материала анода 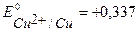 В. Так как равновесный потенциал окисления меди значительно отрицательнее равновесных потенциалов выделения кислорода и хлора, то на аноде в первую очередь пойдет процесс окисления медного электрода. Если при электролизе на катоде и аноде не будут достигнуты равновесные потенциалы систем
В. Так как равновесный потенциал окисления меди значительно отрицательнее равновесных потенциалов выделения кислорода и хлора, то на аноде в первую очередь пойдет процесс окисления медного электрода. Если при электролизе на катоде и аноде не будут достигнуты равновесные потенциалы систем 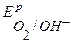 и
и  (небольшие поляризации D Е К, D Е А и плотности тока i), то электродные процессы будут следующие:
(небольшие поляризации D Е К, D Е А и плотности тока i), то электродные процессы будут следующие:
K-: Cu2+ + 2  → Cu
→ Cu
A+: Cu → Cu2+ + 2  .
.
При больших напряжениях электролизера U, могут быть достигнуты  ,
,  и
и  , тогда начнется газовыделение и к указанным уравнениям электродных процессов добавятся уравнения из примера 3.3.
, тогда начнется газовыделение и к указанным уравнениям электродных процессов добавятся уравнения из примера 3.3.
Благодаря растворению под действием тока медного анода запас ионов Cu2+ в растворе электролита будет восполняться, и процесс образования медного покрытия на катоде будет идти более интенсивно, чем в случае использования инертных электродов (пр. 3.3.).
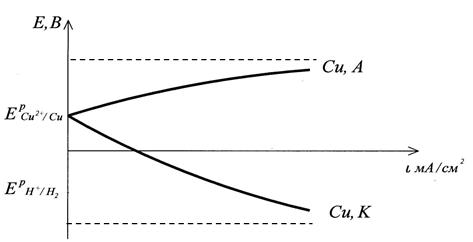
Рис. 3.3. Поляризационные кривые процесса электролиза водного раствора хлорида меди на медных электродах.
Пример 5. Рассмотрите электролиз водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах. Напишите уравнения электродных процессов. Рассчитайте выход по току веществ, если на катоде одновременно образовалось 30г Sn, 52г Pb и 2,8л Н2 (условия нормальные).
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
Pb(NO3)2 → Pb2+ + 2NO3-
Sn(NO3)2 → Sn2+ + 2NO3- H2O  H+ + OH-.
H+ + OH-.
Соли Sn(NO3)2 и Pb(NO3)2 образованы слабыми основаниями и сильной кислотой, следовательно, при их растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н+, раствор электролита будет иметь слабокислую реакцию среды (примем рН ≈ 5).
Определим равновесные потенциалы возможных процессов на аноде и катоде:
К-: 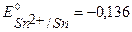 B,
B, 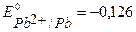 B,
B,
 В.
В.
т.к.  ,
, 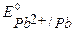 и
и  имеют близкое значение, то на катоде будут параллельно протекать процессы восстановления ионов Pb2+, Sn2+ и Н+ из раствора электролита. На аноде ионы NO3-, как сложные кислородсодержащие ионы, окисляться не будут, и в данном растворе электролита на нерастворимом аноде будет идти только процесс окисления ионов ОН-.
имеют близкое значение, то на катоде будут параллельно протекать процессы восстановления ионов Pb2+, Sn2+ и Н+ из раствора электролита. На аноде ионы NO3-, как сложные кислородсодержащие ионы, окисляться не будут, и в данном растворе электролита на нерастворимом аноде будет идти только процесс окисления ионов ОН-.
Таким образом, на электродах протекают следующие процессы:
K-: Pb2+ + 2 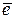 → Pb
→ Pb
Sn2+ + 2 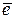 → Sn
→ Sn
2H+ + 2 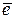 → H2
→ H2
A+: H2O → O2 + 4H+ + 4 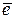 .
.
Запишем массы и объем (при нормальных условиях) моль эквивалентов веществ, образовавшихся на катоде: 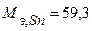 г/моль,
г/моль,  г/моль,
г/моль,  л/моль
л/моль
По закону Фарадея определим количество электричества, необходимое для получения на катоде заданного количества вещества (н.у.):
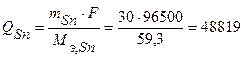 Кл,
Кл,
 Кл,
Кл,
 Кл.
Кл.
Суммарное количество электричества, прошедшее через катод:
 Кл.
Кл.
Определим выход по току (Bj) для всех процессов электролиза:
 o/o, (т.к. на аноде идет один процесс);
o/o, (т.к. на аноде идет один процесс);
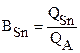 100 % =
100 % = 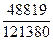 100% = 40,2%;
100% = 40,2%;
 100% = 39,9%;
100% = 39,9%;  100% = 19,9%.
100% = 19,9%.

Рис. 3.4. Поляризационные кривые процесса электролиза водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах.
Пример 6. Рассмотрите процесс рафинирования никеля, содержащего примеси цинка и меди в водном растворе H2SO4. Какие процессы будут протекать на аноде и катоде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение. Рафинирование – очистка металла от примесей с помощью электролиза. На аноде растворяются основной металл и примеси, потенциал которых отрицательнее основного металла. Примеси, имеющие более положительный потенциал, не растворяются и выпадают из анода в виде шлама. На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал.
Анод – очищаемый металл Ni с примесями Zn и Cu. Ионный состав раствора электролита: H+, SO42-, OH-. Запишем равновесные потенциалы возможных электродных процессов при рН = 2:
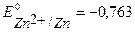 B,
B, 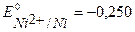 B,
B, 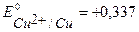 B,
B,
 В,
В, 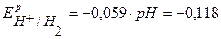 B.
B.
Так как 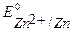 <
< 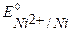 <
<  <
<  , то первым на аноде при рафинировании пойдет процесс окисление примесей цинка, затем - окисление основного металла (никеля), примеси меди не растворяются, а выпадают в осадок (шлам) в виде частиц металла по окончании процесса.
, то первым на аноде при рафинировании пойдет процесс окисление примесей цинка, затем - окисление основного металла (никеля), примеси меди не растворяются, а выпадают в осадок (шлам) в виде частиц металла по окончании процесса.
Так как 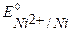 >
> 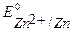 , и концентрация ионов никеля выше, чем концентрация ионов цинка, то на катоде осаждается чистый никель. Однако, в начале процесса, когда в растворе электролита отсутствуют ионы Ni2+, на катоде идет процесс выделения водорода.
, и концентрация ионов никеля выше, чем концентрация ионов цинка, то на катоде осаждается чистый никель. Однако, в начале процесса, когда в растворе электролита отсутствуют ионы Ni2+, на катоде идет процесс выделения водорода.
Запишем уравнения электродных процессов:
А+: Zn → Zn2+ + 2 
Ni → Ni2+ + 2 
K-: 2H+ + 2  → H2
→ H2
Ni2+ + 2  → Ni.
→ Ni.
Время, необходимое для рафинирования, рассчитаем по закону Фарадея (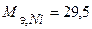 г/моль):
г/моль):
 c или τ = 9,27 ч.
c или τ = 9,27 ч.
Задачи по коррозии
Пример.1. Имеется спай олова (Sn) с серебром (Ag). Определите возможность коррозии при эксплуатации изделия в щелочной среде (рН = 9) при контакте с кислородом. Напишите уравнения возможных коррозионных процессов.
Решение. По табл.1 приложения определим стандартные электродные потенциалы металлов:
 B,
B,  B,
B,
т.к. 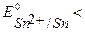
 , то в образующейся гальванической паре анодом будет олово, а катодом – серебро.
, то в образующейся гальванической паре анодом будет олово, а катодом – серебро.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
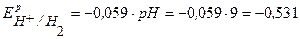 B,
B,
 B.
B.
Поскольку 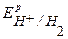 <
<  <
< 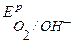 , то возможной будет только коррозия олова под действием кислорода:
, то возможной будет только коррозия олова под действием кислорода:
A– : Sn → Sn2+ + 2  .
.
K+ : O2 + 2H2O + 4  → 4OH–.
→ 4OH–.
Пример 2. При коррозии железного изделия с поглощением кислорода за 3 мин образовалось 0,125г Fe(OH)2. Вычислите объем кислорода, израсходованного на коррозию железа, силу коррозионного тока и массу металла, разрушенного коррозией.
Решение. Рассчитаем количество моль-эквивалентов образовавшегося Fe(OH)2:
 моль-экв.
моль-экв.
Поскольку все вещества взаимодействуют в эквивалентных количествах, то разрушилось 2,8.10-3 моль-эквивалентов Fe и израсходовалось столько же моль-эквивалентов O2. 
 моль-экв.
моль-экв.
Тогда объем кислорода (н.у.), израсходованного на коррозию железа:
 мл.
мл.
По закону Фарадея рассчитаем силу коррозионного тока:
 А.
А.
Определим массу прокорродировавшего железа: 
 г.
г.
Пример 3. Предложите анодное покрытие для защиты железного изделия от электрохимической коррозии в кислородсодержащей среде при рН = 7, р газ =1. Напишите уравнения коррозионных процессов при нарушении целостности покрытия.
Решение. В качестве анодного покрытия для Fe можно использовать металлы с более отрицательным значением потенциала, (например, Zn, Cr, Al и др.). Например, выберем хром, стандартный потенциал 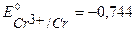 В, более отрицательный, чем
В, более отрицательный, чем 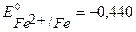 В.
В.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
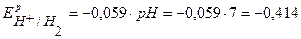 В,
В,
 В.
В.
т.к. 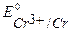 <
< 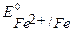 , то при нарушении целостности хромового покрытия на железном изделии роль анода будет выполнять хром.
, то при нарушении целостности хромового покрытия на железном изделии роль анода будет выполнять хром.
Так как 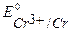 <
<  ,
, 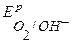 , то в данной среде термодинамически возможна коррозия хрома с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна коррозия хрома с кислородной и водородной деполяризацией:
A- : Cr → Cr3+ + 3 
K+ : O2 + 2H2O + 4  → 4OH-
→ 4OH-
2H2O + 2  → H2 + 2OH-
→ H2 + 2OH-
В нейтральной среде хром отличается высокой коррозионной стойкостью вследствие склонности к пассивации. Продукты коррозии хрома (Cr2O3 , Cr(OH)3 и др.) образуют на поверхности металла плотные труднорастворимые оксидно-солевые пленки, обладающие защитными свойствами, которые затрудняют контакт металла с окислителем и тормозят дальнейший процесс коррозии. Поэтому, хотя термодинамически коррозия возможна, железное изделие c хромовым покрытием реально не разрушается под действием коррозии.
Пример 4. Предложите катодное покрытие для защиты железного изделия от электрохимической коррозии в кислородсодержащей среде при рН = 8 и р газ =1. Напишите уравнения процессов в коррозионном гальваническом элементе при нарушении целостности покрытия.
Решение. В качестве катодного покрытия для Fe можно использовать металлы с более положительным значением потенциала, (например, Ni, Cu, Ag и др.). Например, выберем медь, стандартный потенциал 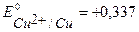 В, более положительный, чем
В, более положительный, чем  .
.
Так как 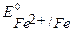 <
<  , то при нарушении целостности медного покрытия на железном изделии роль анода будет выполнять железо.
, то при нарушении целостности медного покрытия на железном изделии роль анода будет выполнять железо.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
 В,
В,
 В.
В.
Так как 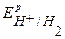 <
< 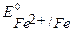 <
< 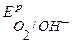 , то в данной среде термодинамически возможна коррозия железа с кислородной деполяризацией и невозможна коррозия с выделением водорода. Уравнения коррозионных процессов:
, то в данной среде термодинамически возможна коррозия железа с кислородной деполяризацией и невозможна коррозия с выделением водорода. Уравнения коррозионных процессов:
A- : Fe → Fe2+ + 2 
K+ : O2 + 2H2O + 4  → 4OH--
→ 4OH--
Железное изделие при этом будет разрушаться.
Пример 5. Напишите уравнения электрохимической коррозии пары Sn-Zn при рН=5 и 298 К. Сколько и какого металла прокорродировало, если в процессе коррозии поглотилось 56 мл кислорода и выделилось 22,4 мл водорода? Определите, чему равен коррозионный ток, если продолжительность коррозии 20 мин.
Решение. Стандартные потенциалы металлов:
 B,
B, 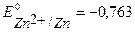 B,
B,
т.к. 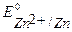 <
< 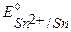 то в заданной гальванической паре анодом будет цинк, а катодом – олово.
то в заданной гальванической паре анодом будет цинк, а катодом – олово.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
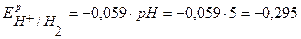 В,
В,
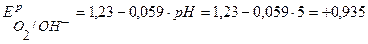 В.
В.
Так как 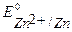 <
< 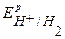 ,
, 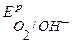 , то в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и водородной деполяризацией:
A- : Zn → Zn2+ + 2 
K+ : O2 + 2H2O + 4  → 4OH-
→ 4OH-
2H2O + 2  → H2 + 2OH-.
→ H2 + 2OH-.
В соответствии с заданием определим количество моль-эквивалентов поглотившегося кислорода и выделившегося водорода (условия считаем нормальными, 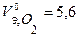 л/моль,
л/моль, 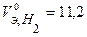 л/моль):
л/моль):
 моль-экв,
моль-экв,
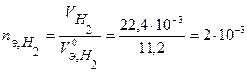 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение 1,2.10-2 моль-эквивалентов вещества. По закону эквивалентов такое же количество вещества растворится на аноде: 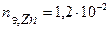 . Масса прокорродировавшего цинка (с учетом массы моля эквивалента цинка
. Масса прокорродировавшего цинка (с учетом массы моля эквивалента цинка 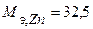 г/моль) равна:
г/моль) равна:
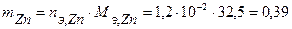 г.
г.
Величина коррозионного тока определяется по закону Фарадея:
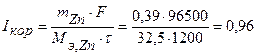 А.
А.
Пример 6. Выберите протектор для защиты стальной конструкции (Fe) в кислой среде (рН=4) на воздухе. Напишите уравнения процессов коррозии. Рассчитайте, как изменится масса протектора, если за некоторое время в процессе коррозии поглотилось 112 мл кислорода и выделилось 112 мл водорода.
Решение. При протекторной защите к металлическому изделию непосредственно или через металлический проводник подсоединяются металл или сплав с более отрицательным значением потенциала, чем потенциал защищаемого изделия. Для железа (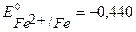 В) в качестве анодного протектора можно использовать магний (
В) в качестве анодного протектора можно использовать магний ( В), цинк (
В), цинк (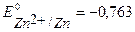 В), алюминий (
В), алюминий (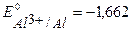 В). При контакте с окислителем металл протектора растворяется, а защищаемое изделие не разрушается. Например, выберем магний. Так как
В). При контакте с окислителем металл протектора растворяется, а защищаемое изделие не разрушается. Например, выберем магний. Так как  <
<  , то в паре с железом магний будет анодом.
, то в паре с железом магний будет анодом.
Согласно уравнению Нернста равновесные потенциалы вероятных окислителей (Н+ и О2) равны:
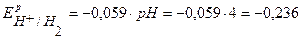 В,
В,
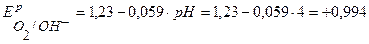 В.
В.
Так как 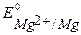 <
< 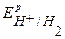 ,
, 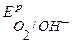 , то в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с кислородной и водородной деполяризацией:
A- : Мg → Мg2+ + 2 
K+ : O2 + 4H+ + 4  → 2H2О
→ 2H2О
2H+ + 2  → H2.
→ H2.
В соответствии с заданием определим количество моль-эквивалентов поглотившегося кислорода и выделившегося водорода (условия считаем нормальными,  л/моль,
л/моль, 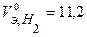 л/моль):
л/моль):
 моль-экв,
моль-экв,
 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение 3.10-2 моль-эквивалентов окислителя. По закону эквивалентов такое же количество протекторного материала растворилось на аноде:  моль-экв. Масса растворившегося протектора (с учетом молярной массы эквивалента магния
моль-экв. Масса растворившегося протектора (с учетом молярной массы эквивалента магния 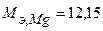 г/моль) равна:
г/моль) равна:
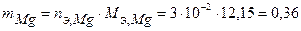 г.
г.