Вопросы для подготовки к экзамену
1. Основные понятия химической термодинамики. Система, равновесное состояние и термодинамический процесс. Экстенсивные и интенсивные свойства. Функции состояния и функции процесса. Может ли термодинамическая величина, являющаяся, в общем случае, функцией процесса, приобретать свойства функции состояния?
Первый закон термодинамики. Внутренняя энергия системы. Теплота и работа как формы передачи энергии. Взаимосвязь этих величин в изохорном и изотермическом процессах. 1-ый закон термодинамики применительно к изотермическому и изохорному процессам. Внутренняя энергия и энтальпия системы, их взаимосвязь.
Тепловой эффект химической реакции. Экзотермические и эндотермические реакции. Стандартные теплоты образования и сгорания химических соединений. Закон Гесса и его термодинамическое обоснование, следствия из закона Гесса. Связь тепловых эффектов химических реакций при постоянном давлении и постоянном объеме. Как на основании экспериментальной величины стандартной теплоты сгорания какого-либо вещества рассчитать его стандартную теплоту образования (примеры реакций)?
Изохорная и изобарная теплоемкость. Зависимость теплоемкости от температуры и агрегатного состояния вещества. Теплоемкость идеального газа. Графическая зависимость изобарной теплоемкости от температуры для вещества в кристаллическом, жидком и газообразном состоянии.
Зависимость внутренней энергии и энтальпии вещества от температуры. Вывод и анализ уравнения Кирхгофа. Влияние температуры на тепловой эффект химической реакции.Укажите характер зависимости  , если: a)
, если: a) 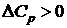 , б)
, б)  , в)
, в)  , г)
, г)  . Использование интегральных форм уравнения для вычисления тепловых эффектов химических процессов при заданной температуре. Интегрирование соответствующих уравнений для случаев: а)
. Использование интегральных форм уравнения для вычисления тепловых эффектов химических процессов при заданной температуре. Интегрирование соответствующих уравнений для случаев: а)  , б)
, б)  . Применение уравнения Кирхгофа для расчета стандартной теплоты реакции при
. Применение уравнения Кирхгофа для расчета стандартной теплоты реакции при  .
.
Графики зависимости  для исходных веществ и продуктов реакции, изменения теплоемкости ΔСp,i = f(T) и теплового эффекта реакции от температуры
для исходных веществ и продуктов реакции, изменения теплоемкости ΔСp,i = f(T) и теплового эффекта реакции от температуры  .
.
Как изменяется энтальпия испарения (парообразования,  ) вещества с повышением температуры (привести график)? Значение энтальпии парообразования при критической температуре.
) вещества с повышением температуры (привести график)? Значение энтальпии парообразования при критической температуре.
Зависимость энтальпии индивидуального вещества от температуры при постоянном давлении (привести соответствующее дифференциальное уравнение). График этой зависимости в широком температурном интервале, включающем температуры плавления и кипения вещества.
2. Самопроизвольные и несамопроизвольные процессы.Второе начало термодинамики, математическое выражение для термодинамическиобратимых и необратимых (самопроизвольных), а также равновесных и односторонних процессов в изолированной системе. Энтропия, ее основные свойства.Энтропия как критерий равновесия и направления самопроизвольного протекания химического процесса в изолированной системе. Изменение энтропии как функция координаты реакции в самопроизвольном процессе (привести график).Зависимость энтропии от температуры и давления. Вывод уравнений для расчета изменения энтропии в термодинамических процессах с участием идеального газа при  и
и 
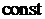 .Постулат Планка. Аналитический и графический методы расчета абсолютной стандартной энтропии вещества в стандартных условиях (
.Постулат Планка. Аналитический и графический методы расчета абсолютной стандартной энтропии вещества в стандартных условиях (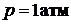 ).
).
3. Объединенное уравнение I и II законов термодинамики. Энергия Гиббса и энергия Гельмгольца, основные свойства. Энергия Гиббса и Гельмгольца как критерии состояния равновесия и направления химического процесса. Зависимость энергии Гиббса от температуры и давления. Зависимость энергии Гельмгольца от температуры и объема. Графическое представление и анализ указанных зависимостей.Зависимость энергии Гиббса и энергии Гельмгольца химической реакции от температуры. Уравнения Гиббса-Гельмгольца. Связь  и
и  для химической реакции.Изменение энергии Гиббса и энергии Гельмгольца в ходе фазовых переходов. Расчет измененияэнергии Гиббса и энергии Гельмгольцав процессах нагревания и расширения идеального газа. Применение таблиц стандартных термодинамических величин для расчета
для химической реакции.Изменение энергии Гиббса и энергии Гельмгольца в ходе фазовых переходов. Расчет измененияэнергии Гиббса и энергии Гельмгольцав процессах нагревания и расширения идеального газа. Применение таблиц стандартных термодинамических величин для расчета  и
и  химических реакций при различных температурах.
химических реакций при различных температурах.
4. Закон действующих масс и его термодинамическое обоснование. Основные количественные характеристики химического равновесия: константа химического равновесия, степень превращения, степень диссоциации, равновесный выход (примеры реакций). Термодинамическая и эмпирическая константы химического равновесия. Способы выражения эмпирической константы химического равновесия (связь  ).Взаимосвязь эмпирической константы химического равновесия газофазной реакции с равновесным числом молей реагентов и общим давлением в реакционной системе. Связь константы равновесия со степенью диссоциации и равновесным давлением. Влияние общего давления и примеси инертного газа на константу химического равновесия и равновесный выход продуктов реакции (примеры реакций). Вывод и анализ уравнения изотермы химической реакции. Направление протекания химического процесса при заданных начальных условиях. Химическое сродство. Стандартное химическое сродство.Варианты уравнения для случаев начала и завершения (т.е. установления состояния равновесия) реакции. Вывод и анализ уравнения изобары Вант-Гоффа.Температурная зависимость константы равновесия химической реакции.Влияние температуры на константу химического равновесия и смещение химического равновесия (примеры реакций). Графические зависимости константы равновесия экзотермической и эндотермической химической реакции от температурыK0 = f(T) и
).Взаимосвязь эмпирической константы химического равновесия газофазной реакции с равновесным числом молей реагентов и общим давлением в реакционной системе. Связь константы равновесия со степенью диссоциации и равновесным давлением. Влияние общего давления и примеси инертного газа на константу химического равновесия и равновесный выход продуктов реакции (примеры реакций). Вывод и анализ уравнения изотермы химической реакции. Направление протекания химического процесса при заданных начальных условиях. Химическое сродство. Стандартное химическое сродство.Варианты уравнения для случаев начала и завершения (т.е. установления состояния равновесия) реакции. Вывод и анализ уравнения изобары Вант-Гоффа.Температурная зависимость константы равновесия химической реакции.Влияние температуры на константу химического равновесия и смещение химического равновесия (примеры реакций). Графические зависимости константы равновесия экзотермической и эндотермической химической реакции от температурыK0 = f(T) и  . Определение среднего и истинного теплового эффекта реакции по зависимости константы химического равновесия от температуры. Аналитические и графические методы.Расчет среднего тепловой эффект химической реакции на основе зависимости
. Определение среднего и истинного теплового эффекта реакции по зависимости константы химического равновесия от температуры. Аналитические и графические методы.Расчет среднего тепловой эффект химической реакции на основе зависимости  .Химическое равновесие в гетерогенных системах (примеры реакций). Примеры выражения константы химического равновесия для гетерогенных реакций с участием газообразных веществ. Методы расчета константы равновесия химической реакции и стандартного химического сродствапри
.Химическое равновесие в гетерогенных системах (примеры реакций). Примеры выражения константы химического равновесия для гетерогенных реакций с участием газообразных веществ. Методы расчета константы равновесия химической реакции и стандартного химического сродствапри  .Методы расчета констант химического равновесия на основании справочных данных о термодинамических величинах.
.Методы расчета констант химического равновесия на основании справочных данных о термодинамических величинах.
5. Фазовые равновесия в однокомпонентной системе. Диаграмма состояния однокомпонентной системыс тройной точкой. Фазовые переходы 1-го рода.Описание фазовых полей, кривых и характерных точек (тройная точка, критическая точка) на диаграмме. Определения фазы, температуры кипения индивидуальной жидкости.Почему для некоторых веществ при нагревании на воздухе возможен переход твердое-пар? Применение к диаграмме правила фаз Гиббса.Уравнения, описывающие линии испарения, возгонки и плавления. Значения тангенса угла наклона линий испарения, возгонки и плавления. Зависимость температуры плавления вещества от внешнего давления. Вывод и анализ уравнения Клапейрона для процесса плавления–кристаллизации. Вывод и анализ уравнения Клапейрона-Клаузиуса для процессов испарения и возгонки. Неопределенное и определенное интегрирование уравнения Клапейрона-Клаузиуса.Вид диаграммы состояния для воды и углекислого газа. Изменение вида диаграммы состояния в зависимости от того, в каком состоянии плотность вещества больше– в жидком или твердом; изменение температуры плавления вещества при изменении внешнего давления для обоих случаев. График p=f(T) для определения истинной теплоты испарения вещества при некоторой температуре Т*. График  и его аналитическое выражение для процесса испарения в случае, когда
и его аналитическое выражение для процесса испарения в случае, когда  . Расчет величины средней теплоты испарения.Аналитические и графические методы определения среднего значения теплоты испарения и теплоты возгонки индивидуального вещества.Расчет термодинамических функций фазовых превращений из экспериментальных данных о зависимости давления насыщенного пара над жидкой фазой от температуры. Определение координат тройной точки с помощью графика lnp = f(1/T) в широком интервале температур. Взаимосвязь энтальпий плавления, испарения и возгонки в тройной точке. Правило Трутона.
. Расчет величины средней теплоты испарения.Аналитические и графические методы определения среднего значения теплоты испарения и теплоты возгонки индивидуального вещества.Расчет термодинамических функций фазовых превращений из экспериментальных данных о зависимости давления насыщенного пара над жидкой фазой от температуры. Определение координат тройной точки с помощью графика lnp = f(1/T) в широком интервале температур. Взаимосвязь энтальпий плавления, испарения и возгонки в тройной точке. Правило Трутона.
6. Идеальные растворы. Парциальные молярные свойства (величины) компонентов раствора, определение и математическое выражение. Связь интегрального свойства раствора с парциальными молярными свойствами компонентов и составом системы. Термодинамическое обоснование, вывод и анализ 1-го уравнения Гиббса-Дюгема.Методы определения парциальных молярных величин (свойств) компонентов раствора (аналитические и графические). Графические методы определения парциальных молярных свойств: метод отрезков и метод касательных (указать величины, откладываемые на осях координат; необходимые формулы).Парциальные молярные функции смешения (относительные парциальные молярные свойства) компонентов раствора. Вывод уравнения, устанавливающего связь термодинамических функций смешения с относительными парциальными молярными свойствами компонентов раствора. Вывод уравнения, связывающего энтропию смешения 
 с концентрациями компонентов идеального раствора. Вывод уравнения, связывающего изменение энергии Гиббса при образовании 1 моля идеального раствора
с концентрациями компонентов идеального раствора. Вывод уравнения, связывающего изменение энергии Гиббса при образовании 1 моля идеального раствора  (
( с парциальными молярными энергиями Гиббса смешения
с парциальными молярными энергиями Гиббса смешения  (
( ) компонентов для бинарной системы.Свойства идеальных (совершенных) растворов. Изменение термодинамических функций смешения
) компонентов для бинарной системы.Свойства идеальных (совершенных) растворов. Изменение термодинамических функций смешения  и
и 
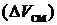 при образовании идеального раствора из чистых компонентов.Термодинамические функции смешения при образовании неидеальных растворов из чистых компонентов. Примеры систем, представляющих практически идеальный раствор в жидкой фазе.
при образовании идеального раствора из чистых компонентов.Термодинамические функции смешения при образовании неидеальных растворов из чистых компонентов. Примеры систем, представляющих практически идеальный раствор в жидкой фазе.
7. Предельно разбавленные растворы. Закон Рауля, вывод и анализ. Графическое представление зависимости  для компонентов бинарного раствора и для системы в целом. Положительные и отрицательные отклонения от закона Рауля. Неидеальные растворы. Применение закона Рауля к неидеальным растворам.Области выполнения законов Рауля и Генри. Константа Генри. Активность и коэффициент активности компонента раствора. Определение коэффициента активности на основании зависимости
для компонентов бинарного раствора и для системы в целом. Положительные и отрицательные отклонения от закона Рауля. Неидеальные растворы. Применение закона Рауля к неидеальным растворам.Области выполнения законов Рауля и Генри. Константа Генри. Активность и коэффициент активности компонента раствора. Определение коэффициента активности на основании зависимости  для неидеального раствора при заданной концентрации. Значения величины
для неидеального раствора при заданной концентрации. Значения величины  .
.
8. Коллигативные свойства разбавленных растворов нелетучих веществ в летучем растворителе, их особенности. Взаимосвязь коллигативных свойств. Моляльность. Закон Рауля. Следствия из закона Рауля: понижение температуры замерзания (отвердевания) и повышение температуры кипения раствора нелетучего вещества по сравнению с температурой замерзания (кипения) чистого растворителя. Обоснование этих явлений спомощью диаграммы состояния однокомпонентной системы. Расчет молекулярной массы с помощью экспериментально определенных величин понижения давления насыщенного пара водного раствора нелетучего растворенного вещества по сравнению с чистым растворителей, изменения температуры замерзания, температуры кипения, осмотического давления для растворов неэлектролитов и электролитов.Изотонический коэффициент. Определение степени диссоциации и ассоциации растворенного вещества. Криоскопия. Криоскопическая постоянная, ее смысл и зависимость от свойств растворителя и растворенного вещества. Эбуллиоскопия. Эбуллиоскопическая постоянная, ее смысл и зависимость от свойств растворителя и растворенного вещества. Осмос, осмотическое давление. Явление самопроизвольного переноса растворителя через полупроницаемую мембрану (схема процесса). Причины, вызывающие переход растворителя через полупроницаемую перегородку.
9. Диаграммы кипения «давление – состав» (T = const) «температура – состав» (p = const) для двухкомпонентной системы, образующей и не образующейазеотроп. Диаграмма кипения для идеального бинарного раствора.Взаимосвязь составов паровой и жидкой фаз. Законы Рауля и Дальтона. Положительные и отрицательные отклонения от закона Рауля. Изменение вида диаграмм в зависимости от типа отклонений. Понятия высококипящий и низкокипящий азеотроп. Зависимость “состав пара - состав жидкости”. Анализ диаграмм – показать схематически (с помощью системы стрелок) изменение фазового состава системы при переходе из жидкого состояния в парообразное, либо наоборот для случая, если в системе больше того или другого компонента, а также для смеси азеотропного состава; определить температуры начала и конца кипения, составы 1-го пузырька пара и последней капли жидкости.Правило фаз Гиббса. Правило рычага. Законы Гиббса-Коновалова.Разделение жидких смесей перегонкой. Возможность разделения азеотропных смесей на чистые компоненты.Принцип ректификации, понятия «дистиллят» и «кубовый остаток».