Урок №
Тема урока: «Спирты».
Изучаем материал, оформляем конспект урока.
Дом.задание выучить формулы спиртов.
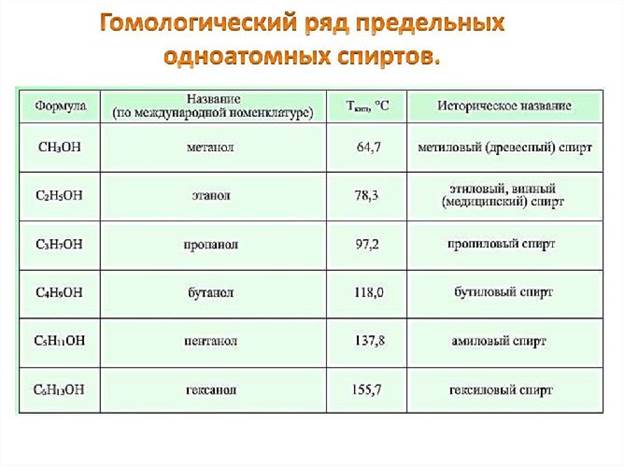
Спирты – производные углеводородов, содержащих одну или несколько гидроксильных групп. В зависимости от количества группы -ОН в соединениях выделяют одно-, двух-, трёх- и многоатомные спирты.
Общая формула одноатомных спиртов – CnH2n+1-OH или CnH2n+2O.
Названия насыщенных спиртов соответствуют гомологическому ряду алканов с суффиксом «-ол».
 Для одноатомных спиртов характерны два типа изомерии:
Для одноатомных спиртов характерны два типа изомерии:
- структурная – изомерия углеродного скелета и положение гидроксильной группы;
Изомерия углеродного скелета характерна спиртам с четырьмя и более атомами углерода. Например, изомеры бутанола (C4H9OH):
- CH3-CH2-CH2-CH2-OH – бутанол-1;
- CH3-CH(CH3)-CH2-OH – 2-метилпропанол-1.
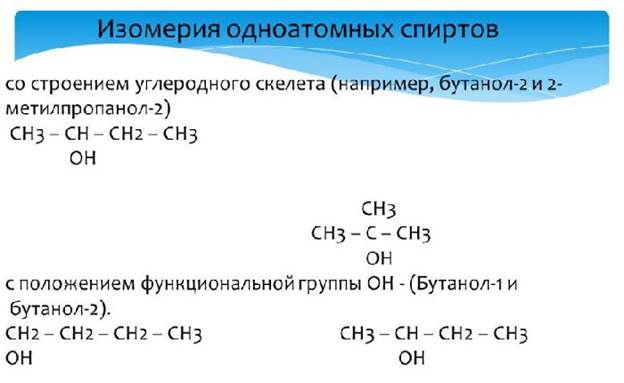
Изомерия по положению гидроксила свойственна спиртам с тремя и более атомами углерода. Например, при «сдвиге» группы -ОН на второй атом углерода пропанола-1 образуется пропанол-2:
- CH3-CH2-CH2-OH – пропанол-1;
- CH3-CH(OH)-CH3 – пропанол-2.

Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт — объясняется одним из способов его получения — перегонкой твердых пород дерева (греч. — вино, опьянеть; вещество, древесина).
Метанол очень ядовит! Он требует осторожного обращения при работе с ним. Под действием фермента алкогольде-гидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96% (по объему) этанола и 4% (по объему) воды. Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди(II) и др.).
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Получение
- гидратация алкенов – присоединение воды:
CH2=CH2 + H2O → CH3CH2OH;
- гидролиз алкилгалогенидов в присутствии водный растворов щелочей:
CH3CH2Сl + NaOH → CH3CH2OH + NaCl;
- восстановление альдегидов (образование первичных спиртов):
CH3CHO + Н2 → CH3-CH2-OH;
- восстановление кетонов (образование вторичных спиртов):
CH3-C(O)-CH3 + Н2 → CH3-CH(OH)-CH3;
- брожение глюкозы (получение этанола):
С6Н12О6 → 2С2Н5ОН + 2СО2
Химические свойства
- со щелочными металлами –
2C2H5OH + 2Na → 2C2H5ONa + H2;
- с органическими и неорганическими кислотами (образование сложных эфиров) –
C2H5OH + CH3COOH → CH3COOC2H5+ Н2 O
- окисления в присутствии перманганата или дихромата калия –
2CH3OH + 3O2 → 2CO2 + 4H2O.
первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
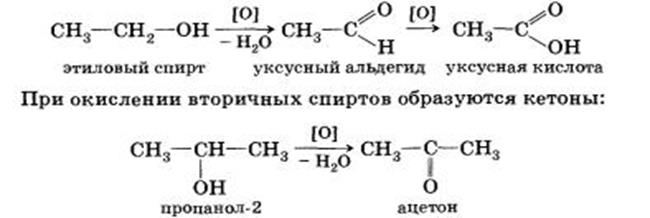
Реакции с разрывом С-О связей:
- дегидратация в присутствии катализатора –
CH3-CH2-CH(OH)-CH3 → CH3-CH=CH-CH3 + H2O;
- замещения гидроксила галогеном –
C2H5OH + HCl → C2H5Cl + H2O.
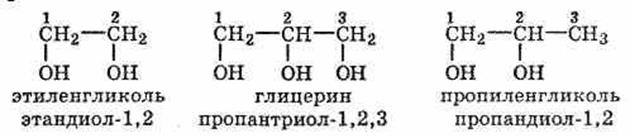
Представители многоатомных спиртов — этиленгликоль и глицерин. Двухатомные спирты, содержащие две гидроксильные группы—ОН, называются гликолями, или диолами, трехатомные спирты, содержащие три гидроксильные группы, — глицеринами, или триолами.
 .
.
Конец формы
Химические свойства
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. Например, этиленгликоль реагирует не только с щелочными металлами, но и с гидроксидами тяжелых металлов.
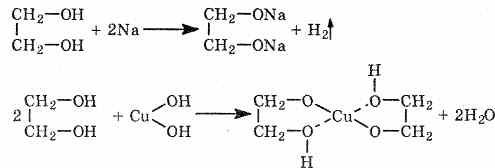
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
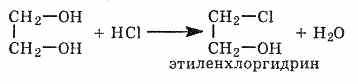
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение ярко-синего цвета.
Эта реакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода -СH(ОН)-СН(ОН)-:

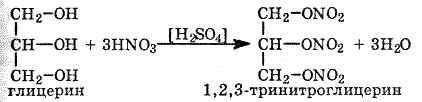
Многоатомные спирты взаимодействуют с кислотами, образуя сложные эфиры. При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
Фенол С6Н5ОН – бесцветное, кристаллическое вещество с характерным запахом. Его t плавления = 40,9 С. В холодной воде он мало растворим, но уже при 70◦С растворяется в любых отношениях. Фенол ядовит. В феноле гидроксильная группа соединена с бензольным кольцом.
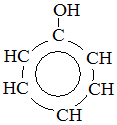 фенол
фенол
Химические свойства
1. Взаимодействие с щелочными металллами.
2C6H5OH + 2Na → 2C6H5ONa + H2 
фенолят натрия
2. Взаимодействие со щелочью (фенол – слабая кислота)
C6H5OH + NaOH → C6H5ONa + H2O
3. Галогенирование.
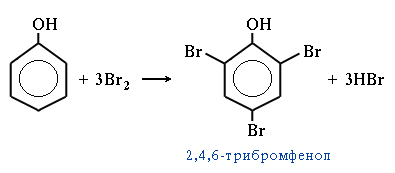
4. Нитрование
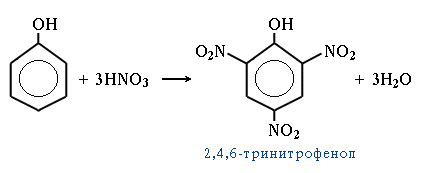
Качественная реакция на фенол
3C6H5OH +FeCl3 → (C6H5O)3Fe +3HCl (фиолетовое окрашивание)
Применение
Основным потребителем фенола какое-то время являлась медицина. Разбавленные водные растворы фенола (карболка 5%) применяли для дезинфекции помещений, белья. Являясь антисептиком, широко применялся в европейской и американской медицине в период Второй мировой войны, но из-за высокой токсичности в настоящее время использование сильно ограничено. В годы первой мировой войны фенол широко использовался для производства сильного взрывчатого вещества — пикриновой кислоты.
Развитие производства фенопластов в конце 19-го века, в первую очередь фенолформальдегидных смол, дало активный толчок развитию рынка фенола. В настоящее время можно выделить несколько основных направлений использования фенола. Один из них – производство лекарственных средств. Большинство этих лекарств — производные получаемой из фенола салициловой кислоты и самого распространенного жаропонижающего - ацетисалициловой кислоты (аспирина). Эфир салициловой кислоты и самого фенола тоже хорошо известен под названием салол. При лечении туберкулеза применяют парааминосалициловую кислоту (сокращенно ПАСК), при конденсации фенола с фталевым ангидридом получается фенолфталеин. Другое направление применения фенола –производство синтетических волокон: нейлона, капрона, но важнейшая область его применения – производство фенолформальдегидных смол.
Также фенол применяется для производства средств защиты растений и для многих других целей -получения присадок к маслам, для селективной очистки масел, ортокрезола, входит в состав некоторых красителей, парфюмерных продуктов, пластификаторов для полимеров.
Получение фенола
История фенола насчитывает уже более 160 лет. Впервые он был выделен из каменноугольной смолы в 1834 г., откуда и получил свое название - карболовая (угольная) кислота