Тема. СПИРТЫ
Получение этанола брожением глюкозы и гидратацией этилена.
Наибольшее значение имеют получение этилового спирта гидратацией этилена и сбраживанием сельскохозяйственного сырья и продуктов его переработки. Сущность спиртового брожения состоит в том, что виноградный сахар (глюкоза) С6Н1206 в присутствии вещества, вызывающего брожение, через ряд стадий превращается в этиловый спирт и двуокись углерода:
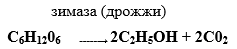
В промышленности для получения спирта пользуются не природным виноградным сахаром, а крахмалом картофеля, хлебных злаков, отходами сахарных заводов. Крахмал предварительно осахаривают под действием особого энзима — диастаза, находящегося в солоде (проросших зернах ячменя или ржи). Осахаривание идет с присоединением воды к крахмалу; при этом образуется дисахарид — мальтоза С12Н22О11:
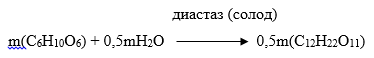
В процессе брожения под влиянием энзима мальтоза гидролизуется в глюкозу:
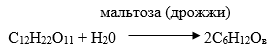
Глюкозу потом подвергают спиртовому брожению.
Гидроксильная группа как функциональная.
Напишите структурную формулу этана и пропана, в которых один атом водорода замените на -ОН группу. СН3 –СН2- ОН; СН3 – СН2 –СН2- ОН
Класс органических соединений, в состав которых, помимо углерода и водорода, входит кислород называется кислородосодержащими органическими соединениями.
Простейшими кислородосодержащими органическими веществами являются спирты. Молекулы спиртов содержат гидроксильную группу, которая является функциональной группой для этого класса. Функциональная группа - группа атомов (или атом) определяющих принадлежность соединения к определенному классу и обусловливающая его важнейшие химические свойства.
Понятие о предельных одноатомных спиртах.
Общая формула спиртов (одноатомных предельных) СnH2n+1OH или R – OH, где R- углеводородный радикал.
Спирты – производные углеводородов, содержащих одну или несколько гидроксильных групп.
Классификация спиртов.
1) По числу гидроксильных групп (ОН) спирты бывают одноатомные и многоатомные (двухатомные, трехатомные).
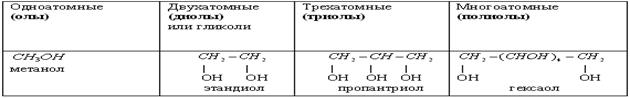
2. По характеру углеводородного радикала спирты бывают предельные, непредельные, ароматические.
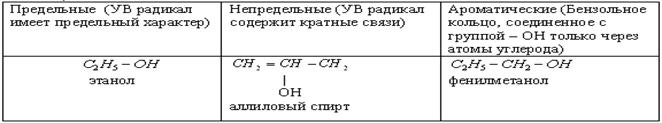
2. По характеру атома углерода, с которым связана гидроксильная группа, спирты бываю первичные, вторичные, третичные.
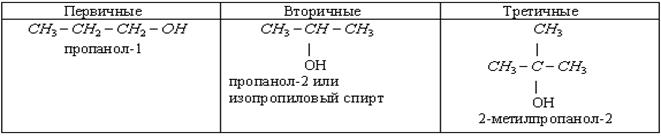
Учитель обращает внимание на то, что четвертичных спиртов не существует, т.к. четвертичный атом С связан с 4 другими атомами С, поэтому на связь с гидроксильной группой нет больше валентностей.
Б) Изомерия спиртов. Для предельных одноатомных спиртов характерны следующие виды изомерии:
- углеродного скелета
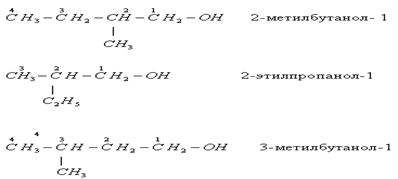
- положения функциональной группы
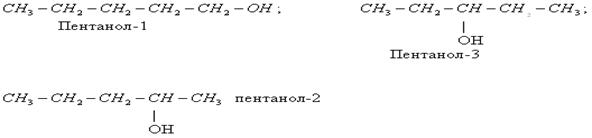
- межклассовая изомерия
(СН3 – СН2 – ОН этиловый спирт и СН3 – О – СН3 диметиловый эфир)
В) Номенклатура спиртов.
К названию углеводорода добавляют количество гидроксогрупп (префикс), затем – суффикс ОЛ, затем указываются номера атомов углерода, с которыми соединены функциональные группы. Например:
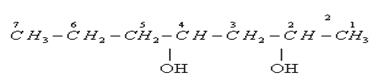
Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН.
2. Основная цепь содержит 7 атомов С, значит соответствующий УВ гептан.
3. Число групп – ОН равно 2, префикс – «ди».
4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название данного спирта - гептандиол-2,4
Химические свойства этанола.
А) Замещение атома водорода в гидроксиле метал лом.
Вещества, получающиеся в результате такого замещения называются алкоголятами:
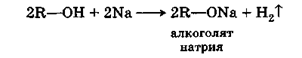 Алкоголяты, образуемые метиловым спиртом, называют метилатами, образуемые этиловым спиртом — этилатами и т. д.
Алкоголяты, образуемые метиловым спиртом, называют метилатами, образуемые этиловым спиртом — этилатами и т. д.
Алкоголяты — твердые вещества, легко растворимые в спирте. Алкоголяты натрия — нестойкие соединения, быстро темнеют (осмоляются) на воздухе, особенно при нагревании. Наиболее устойчив метилат натрия. В присутствии следов влаги алкоголяты натрия разлагаются, и вновь образуется спирт:
Б) Замещение атома водорода в гидроксиле ацильной группой с образованием сложных эфиров.
При взаимодействии спиртов с органическими кислотами (лучше в присутствии следов сильных кислот) получаются сложные эфиры:
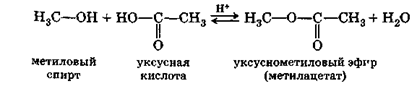 Реакция образования сложных эфиров называется реакцией этерификации. Реакция этерификации обратима: вода в присутствии кислот или щелочей разлагает сложные эфиры с образованием исходных веществ — кислоты и спирта. Такое гидролитическое разложение сложных эфиров называется реакцией гидролиза. Реакция этерификации, а также образующиеся в результате ее эфиры имеют очень важное промышленное значение.
Реакция образования сложных эфиров называется реакцией этерификации. Реакция этерификации обратима: вода в присутствии кислот или щелочей разлагает сложные эфиры с образованием исходных веществ — кислоты и спирта. Такое гидролитическое разложение сложных эфиров называется реакцией гидролиза. Реакция этерификации, а также образующиеся в результате ее эфиры имеют очень важное промышленное значение.
В) Межмолекулярная дегидратация.
При нагревании избытка спирта с серной кислотой или при пропускании паров спирта через порошкообразный безводный сульфат алюминия при 200°С наряду с этиленовыми углеводородами получаются и простые эфиры:
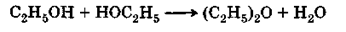
Б) Окисление спиртов.
Окисление обычно проводят сильными окислителями, например К2Сг207 + Н2SО4или КМп04 + + Н2SО4. При окислении спиртов действие окислителя направляется на тот углеродный атом, который уже связан с гидроксильной группой. Следовательно, в зависимости от того, какой спирт окисляется — первичный, вторичный или третичный, получаются различные продукты окисления.
При окислении вторичных спиртов образуются кетоны:
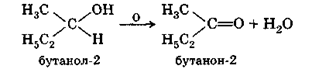 Окисление первичных спиртов происходит аналогично, но так как в первичных спиртах у углеродного атома, связанного с гидроксилом, на один атом водорода больше, чем во вторичных, то продуктами окисления в этом случае являются альдегиды:
Окисление первичных спиртов происходит аналогично, но так как в первичных спиртах у углеродного атома, связанного с гидроксилом, на один атом водорода больше, чем во вторичных, то продуктами окисления в этом случае являются альдегиды:
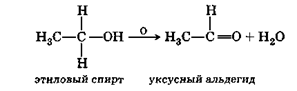 Эту реакцию трудно осуществить с высоким выходом из-за легкой окисляемости образовавшегося альдегида до соответствующей карбоновой кислоты.
Эту реакцию трудно осуществить с высоким выходом из-за легкой окисляемости образовавшегося альдегида до соответствующей карбоновой кислоты.