Многоатомные спирты
Многоатомными называются спирты, содержащие в молекуле две гидроксильные группы и более. В зависимости от количества гидроксильных групп они делятся на двухатомные (две группы OH), или диолы; трехатомные, или триолы и т. д. Двухатомные спирты называют также гликолями.
Способы получения
Получают многоатомные спирты теми же способами, что и одноатомные, с той лишь разницей, что в молекулу вводится не одна, а несколько гидроксильных групп.
1. Гидролиз галогенпроизводных:
2 NaOH
CH3 – CH – CH2 – CH2 ¾¾® CH3 – CH – CH2 – CH2
½ ½ - 2 NaCl ½ ½
Cl Cl OH OH
1,3-дихлорбутан 1,3-бутандиол
2. Гидроксилирование алкенов (реакция Вагнера):
[O], H2O
СН3 – СН = СН2 ¾¾® СН3 – СН – СН2
пропилен ½ ½
ОН ОН
1,2-пропандиол
В качестве окислителей применяется щелочной раствор КМnО4 или Н2О2.
3. Получение из α-оксидов:
H2O; H+
СН2 – СН – СН3 ¾¾¾® СН2 – СН – СН3
\ / ½ ½
О ОН ОН
окись пропилена 1,2-пропандиол
При гидратации α-оксидов обычно образуются гликоли.
Физические и химические свойства
По своим физическим свойствам низшие гликоли – хорошо растворимые в воде вязкие жидкости, многие из которых обладают сладким вкусом. Введение в молекулу второй гидроксильной группы сильно сказывается на свойствах спиртов: диолы кипят при более высоких температурах, чем одноатомные спирты, что связано с появлением дополнительных водородных связей.
Химические свойства многоатомных спиртов близки к свойствам одноатомных. В реакциях может участвовать одна или несколько гидроксильных групп.
Повышенная подвижность атомов водорода гидроксильных групп
(рКа СН2ОН–СН2ОН равна 14,7) – особенность многоатомных спиртов. Они превращаются в алкоголяты не только при взаимодействии с натрием или калием, но и с гидроксидами тяжелых металлов, образуя комплексные соединения:
H
½
H2C – O O – CH2
H2C – OH HO – CH2 ½ \ / ½
½ + Cu(OH)2 + ½ ¾® ½ Cu ½ + 2H2O.
H2C – OH HO – CH2 ½ / \ ½
этиленгликоль H2C – O O – CH2
½
H
комплексное соединение
Окисление гликолей:
O O
СН2 – ОН [O] // [O] //
½ ¾® HO – CH2 – C ¾® HO – CH2 – C.

 СН2 – ОН \ \
СН2 – ОН \ \
H OH
этиленгликоль гликолевый альдегид гликолевая кислота
О О O O O O
\\ // [O] \\ // [O] \\ //
С – С ¾¾¾® C – C ¾® C – C.
/ \ / \ / \
Н Н H OH HO OH
глиоксаль глиоксиловая щавелевая
кислота кислота
Реакция протекает легко, по продукту реакции до известной степени можно судить о строении гликолей.
Получение сложных эфиров кислот
 О О
О О
СН2 – ОН СН3СООН СН2 – О – С – СН3 СН3СООН СН2 – О – С – СН3
½ ¾¾¾® ½ ¾¾¾® ½
 СН2 – ОН – Н2О СН2ОН – Н2О СН2 – О – С – СН3.
СН2 – ОН – Н2О СН2ОН – Н2О СН2 – О – С – СН3.
этиленгликоль неполный эфир
О
полный эфир
Дегидратация гликолей. Гликоли, отщепляя воду (в присутствии кислот или хлорида цинка), превращаются в разнообразные соединения, характер которых зависит от строения гликоля, условий реакции. Отнятие воды может протекать внутримолекулярно и межмолекулярно:
а) внутримолекулярная дегидратация:
СН2 - СН2 CH2 – CH2
½ ½ H2SO4, t1 / \
СН2 СН2 ¾¾® CH2 CH2
½ ½ – Н2О \ /
 ОН Н О О
ОН Н О О
тетрагидрофуран
б) межмолекулярная дегидратация
O
 / \
/ \
СН2 –О Н НO – СН2 H2SO4 CH2 CH2
 ½ + ½ ¾¾® ½ ½
½ + ½ ¾¾® ½ ½
CH2 – O H HO – CH2 – 2 H2O CH2 CH2
\ /
O
диоксан
Водные растворы этиленгликоля замерзают при температурах ниже нуля
(50 %-й при –37 oС), что позволяет применять их для приготовления антифризов – замерзающих при низких температурах жидкостей, используемых для охлаждения двигателей внутреннего сгорания.
Глицерин, 1, 2, 3 -пропантриол
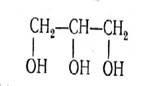 .
.
Глицерин – единственный практически важный представитель трехатомных спиртов – сиропообразная сладкая жидкость, без цвета, хорошо растворимая в воде. Водные растворы глицерина замерзают при низких температурах (67 %- й раствор при –46,5 °С); применяются в качестве антифризов.
Глицерин широко распространен в природе, является основным спиртом, участвующим в построении молекул различных групп липидов. В промышленности глицерин получают гидролизом ацилглицеринов (триглицеридов):
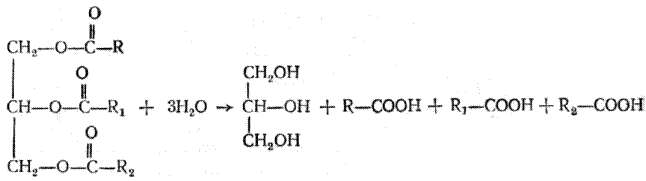
Это – старый способ, не потерявший своего значения и в настоящее время. Однако получение глицерина гидролизом триглицеридов связано с использованием для технических целей больших количеств ценных пищевых продуктов – жиров и масел, поэтому этот способ постепенно заменяется синтетическим, основным сырьем в котором является пропилен:
450–500 oC
СН2 = СН – СН3 + Cl2 ¾¾¾¾® CH2 = CH – CH2Cl + HCl;
пропилен аллилхлорид
150–160 oC
СН2 = СН – СН2Cl + NaOH ¾¾¾® CH2 = CH – CH2OH + NaCl;
аллиловый спирт
 ¾¾® CH2Cl – CHOH – CH2OH
¾¾® CH2Cl – CHOH – CH2OH
СН2 = СН – СН2ОН + HOCl –
¾¾® CH2OH – CHCl – CH2OH
монохлоргидрины глицерина
CH2Cl – CHOH – CH2OH 150 oC CH2 – CH – CH2
+ 2NaOH ¾¾¾® ½ ½ ½.
CH2OH – CHCl – CH2OH – 2NaCl OH OH OH
глицерин
Глицерин широко применяется во многих отраслях промышленности. Основное его количество расходуется для получения производных – глифталевых смол, нитроглицерина. Глифталевые смолы (глифтали) – полиэфиры глицерина и фталевой кислоты – применяются для изготовления лаков. Глицеринтринитрат, или как его называют в технике, «нитроглицерин» – сложный эфир глицерина и азотной кислоты – получают действием азотной кислоты в присутствии серной кислоты на глицерин:
CH2 – OH CH2 – ONO2
½ H2SO4 ½
CH – OH + 3 HONO2 ¾¾® CH – ONO2 + 3 H2O
½ ½
CH2 – OH CH2 – ONO2
глицерин глицеринтринитрат (нитроглицерин)
Глицеринтринитрат – взрывчатое вещество огромной силы (взрывается от легкого толчка). Для взрывных работ часто применяется смесь, которая состоит из
75 % нитроглицерина и 25 % инфузорной земли, называемая динамитом, т.к. она безопаснее в работе.
ПРОСТЫЕ ЭФИРЫ
Способы получения
Простые эфиры общей формулы R –O – R получают одним из следующих способов:
– реакцией алкоголятов с галогеналкилами
R1 – ONa + R2X ¾® R1 – O – R2 + NaX;
– дегидратацией спиртов в присутствии серной кислоты, выполняющей роль катализатора и водоотнимающего средства
H2SO4
2 ROH ¾¾® R – O – R + H2O.
Реакция протекает в две стадии:
а) сначала ионы водорода (Н+) образуют с малоактивной молекулой спирта промежуточное соединение
+
R – OH + H+ ® R – O – H,
½
H
б) которое затем быстро реагирует с другой молекулой спирта с образованием эфира
+
R – O – H + R – OH ® R – O – R + H2O + H+.
½
H
Присутствие концентрированной серной кислоты способствует связыванию образующейся воды, что смещает равновесие обратимой реакции в сторону образования эфира.
Химические свойства
Простые эфиры относятся к числу малоактивных органических соединений, что связано с высокой прочностью связи С – О. Они, в отличие от сложных эфиров, не гидролизуются водой.
Однако простые эфиры расщепляются по связи С – О концентрированными кислотами (серной, иодистоводородной) с образованием
а) алкил и диалкилсульфатов
 2 R – OSO3H
2 R – OSO3H
R – O – R + H2SO4;
 |
R – O – SO2 – O – R + H2O
б) R – O – R + HJ ® R – OH + RJ.
Простые эфиры за счет неподеленной пары электронов атома кислорода реагируют с сильными минеральными кислотами с образованием оксониевых соединений:
R
\ +
R – O – R + H+ + HSO4- ® OH HSO4-.
/
R
диалкилоксоний сульфат
Отдельные представители
Из простых эфиров наибольшего внимания заслуживает этиловый эфир, часто называемый просто эфиром. Его получают дегидратацией этилового спирта в присутствии серной кислоты. Поэтому иногда его еще называют серный эфир.
Этиловый эфир – бесцветная прозрачная жидкость с приятным запахом, т. кип. 35,6 оС. Он мало растворим в воде: в 100 частях воды при 20 оС растворяется 6,5 частей эфира. Вода также частично растворяется в эфире. Эфир смешивается со спиртом в любых соотношениях, легко испаряется и воспламеняется.
Этиловый эфир находит разностороннее использование, особенно в качестве хорошего растворителя. В медицине его применяют для наркоза и усиления сердечной деятельности.
При обращении с эфиром следует соблюдать следующие правила техники безопасности:
1) так как пары эфира примерно в 2,5 раза тяжелее воздуха, то нужно учесть, что они не сразу с ним смешиваются, а этот факт увеличивает опасность взрыва и пожара;
2) при хранении эфир окисляется с образованием взрывчатых перекисных соединений, поэтому перед работой необходимо проверить простой качественной реакцией, не содержит ли эфир перекиси. Для этого пробу эфира встряхивают с подкисленным раствором иодида калия. Побурение раствора свидетельствует о наличии перекисей, которые окисляют иодистый водород до иода. Чтобы очистить эфир от перекисей, его встряхивают с водным раствором сульфата железа (II).