Спирты.
Спирты- органические соединения, производные углеводородов, содержащие одну или несколько групп ОН, (ОН- -гидроксогруппа)
Общая формула предельных одноатомных спиртов- СnH2n+1ОН
ОН— ол.
 CH3ОН – метанол
С2Н5 ОН – этанол гомологи
С3Н7 ОН - пропанол
С4Н9 ОН - бутанол
· Изомеры: С4Н9ОН
а) углеродной цепи
CH3- CH2-CH2-CH2ОН бутанол-1
CH3- CH-CH2ОН
|
CH3 2-метилпропанол-1
б) положения группы ОН
CH3 - CH-CH2-CH3
|
ОН бутананол-2;
в) межклассовая - с простыми эфирами.
С2Н5 ОС2Н5 – диэтиловый эфир
Классификация:
1. По числу групп ОН
а) одноатомные С3Н7 ОН
б) многоатомные
ОНCH2CH2ОН этандиол-1,2;
2. По расположению группы ОН
а) первичные – группа ОН связана с первичным атомом углерода:бутанол-1
б) вторичные - группа ОН связана со вторичным атомом углерода: бутанол-2
г) третичные - группа ОН связана с третичным атомом углерода.
CH3
|
CH3- C-CH3
|
2-метилпропанол-2 ОН
3. 3. По природе углеводор. радикала - R
4. - алифатические – бутанол,
5. - циклические – циклогексиловый
6. С6Н11ОН
- ароматические - фенилметанол
С6Н5CH2ОН CH3ОН – метанол
С2Н5 ОН – этанол гомологи
С3Н7 ОН - пропанол
С4Н9 ОН - бутанол
· Изомеры: С4Н9ОН
а) углеродной цепи
CH3- CH2-CH2-CH2ОН бутанол-1
CH3- CH-CH2ОН
|
CH3 2-метилпропанол-1
б) положения группы ОН
CH3 - CH-CH2-CH3
|
ОН бутананол-2;
в) межклассовая - с простыми эфирами.
С2Н5 ОС2Н5 – диэтиловый эфир
Классификация:
1. По числу групп ОН
а) одноатомные С3Н7 ОН
б) многоатомные
ОНCH2CH2ОН этандиол-1,2;
2. По расположению группы ОН
а) первичные – группа ОН связана с первичным атомом углерода:бутанол-1
б) вторичные - группа ОН связана со вторичным атомом углерода: бутанол-2
г) третичные - группа ОН связана с третичным атомом углерода.
CH3
|
CH3- C-CH3
|
2-метилпропанол-2 ОН
3. 3. По природе углеводор. радикала - R
4. - алифатические – бутанол,
5. - циклические – циклогексиловый
6. С6Н11ОН
- ароматические - фенилметанол
С6Н5CH2ОН
| Строение | Химические свойства | Получение |
δ- δ+
R → O ← H
-электронная плотность смещена к атому кислорода (атом Н при группе ОН становится более подвижным)
- в углеводородном радикале sp3- гибридизация
- у атома О есть свободные (несвязанные) электронные пары.
- величина валентного угла связи между углеводородным радикалом, кислородом и водородом 1100
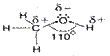
 R →Оδ-
Hδ+
Между молекулами возникают водородные связи, образуются ассоциаты.
δ- δ+ δ- δ+ δ- δ+
O – H … O – H … O – H
| | |
R R R
Поэтому среди спиртов нет газов
С1-С15 – жидкости
>15 – твердые вещества
Растворимы в воде, сами являются растворителями.
CH3ОН–метанол; древесный спирт
С2Н5 ОН – этанол
Спирт, содержащий 4-4,5% воды - ректификат, а доли % - абсо-лютный; полученный гидроли-зом из глюкозы (крахмала) – пи-щевой или винный, из глюко-зы (целлюлозы)- гидролизный. R →Оδ-
Hδ+
Между молекулами возникают водородные связи, образуются ассоциаты.
δ- δ+ δ- δ+ δ- δ+
O – H … O – H … O – H
| | |
R R R
Поэтому среди спиртов нет газов
С1-С15 – жидкости
>15 – твердые вещества
Растворимы в воде, сами являются растворителями.
CH3ОН–метанол; древесный спирт
С2Н5 ОН – этанол
Спирт, содержащий 4-4,5% воды - ректификат, а доли % - абсо-лютный; полученный гидроли-зом из глюкозы (крахмала) – пи-щевой или винный, из глюко-зы (целлюлозы)- гидролизный.
| · Реакции идут по ионному типу
а) кислотные свойства (выражены слабо)
Связь Oδ←Hδ+ поляризована, (взаимодействуют с активными Ме, но не реагируют со щелочами)
2RОН + 2Na → 2RONa + H2↑ (алкоголят натрия)
с увеличением поляризации группы –ОН кислотность усиливается (2,2диметил этанол-1 или введение F)
б) реакции нуклеофильного замещения
- с галогеноводородами или их концентрированными водными растворами
(реакция первичных спиртов с HCl практически не идет)
Н+
С2Н5 ОН+ HBr D С2Н5 Br + Н2О
- реакции этерификации (с кислотами)
Н+, t0
СН3СООН + НОС2Н5D СН3СООС2Н5 + Н2О
 → R-O- SO2-OH + Н2О
RОН + НО-SO2-OH → R-O- SO2-OR + Н2О
в) реакции дегидратации:
· С2Н5ОНизб.+НОС2Н5→С2Н5ОС2Н5 +Н2О (t0<1400, Н2SO4)
· С2Н5 ОН → CH2=CH2 + Н2О (t0>1400, Н2SO4 -изб,)
t0,Al2O3
· 2С2Н5 ОН → CH2=CH- CH=CH2+ Н2О + Н2
- вторичные спирты: атом Н отщепляется от наименее гидрированного углеродного атома (правило Зайцева).
CH3- CH(ОН)-CH2-CH3→ CH3- CH= CH-CH3 + Н2О
· дегидрирование: → R-O- SO2-OH + Н2О
RОН + НО-SO2-OH → R-O- SO2-OR + Н2О
в) реакции дегидратации:
· С2Н5ОНизб.+НОС2Н5→С2Н5ОС2Н5 +Н2О (t0<1400, Н2SO4)
· С2Н5 ОН → CH2=CH2 + Н2О (t0>1400, Н2SO4 -изб,)
t0,Al2O3
· 2С2Н5 ОН → CH2=CH- CH=CH2+ Н2О + Н2
- вторичные спирты: атом Н отщепляется от наименее гидрированного углеродного атома (правило Зайцева).
CH3- CH(ОН)-CH2-CH3→ CH3- CH= CH-CH3 + Н2О
· дегидрирование:
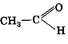 Ni
СН3CH2ОН → + Н2
г) окисление
· полное горение: 2CH3ОН + 3О2 → 2СО2 + 4Н2О + Q
· первичные спирты окисляются до альдегидов (К2Cr2O7 + Н2SO4 или СuО): С2Н5ОН+ CuO→СН3CНО +Cu+Н2О (t0)
или до карбоновых кислот (в жестких условиях: К2Cr2O7 + Н2SO4,,t0); вторичные спирты окисляются до кетонов (при действии кислого р-ра КMnO4 может идти разрушение углеродного скелета).
· третичные спирты не окисляются, разрушаются.
д) с аммиаком: Al2O3; t0
СН3ОН+NH3 → CH3NH2+Н2О - реакция протекает трудно Ni
СН3CH2ОН → + Н2
г) окисление
· полное горение: 2CH3ОН + 3О2 → 2СО2 + 4Н2О + Q
· первичные спирты окисляются до альдегидов (К2Cr2O7 + Н2SO4 или СuО): С2Н5ОН+ CuO→СН3CНО +Cu+Н2О (t0)
или до карбоновых кислот (в жестких условиях: К2Cr2O7 + Н2SO4,,t0); вторичные спирты окисляются до кетонов (при действии кислого р-ра КMnO4 может идти разрушение углеродного скелета).
· третичные спирты не окисляются, разрушаются.
д) с аммиаком: Al2O3; t0
СН3ОН+NH3 → CH3NH2+Н2О - реакция протекает трудно
| 1.Гидролизом алкилгалогенидов:
hν; Сl2 NaOH, Н2О
СnH2n+2 → СnH2n+1Cl →СnH2n+1ОН
2.Восстановлением альдегидов и кетонов
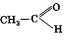 Pt
+ Н2 → СН3CH2ОН
3.Восстановлением карбоновых кислот и сложных эфиров (с использованием алюмгидрата лития -LiAlH4)
LiAlH4
RCOOH → RCH2OH
H+, Н2О
LiAlH4
С6Н5СООСН3 → С6Н5СН2ОН + СН3ОН
метилбензоат бензиловый спирт метанол
4. Гидратацией алкенов
H+,t0
CH2 =CH2+ Н2О → СН3CH2ОН
(в промышленности)
Частные реакции:
а) метанол - промышленный способ
из синтез – газа: СО + 2Н2 → CH3ОН
Р=5-10МПа, t0250-4000С,кат:СuO,Cr2O3, ZnO
б) этанол - гидролизом сахаров
ферменты ферменты
(С6Н11О5)n → С6Н12О6 → С2Н5ОН сахар глюкоза -СО2 спирт
Сахар извлекали из сахарной патоки, содержащейся в сахарном тростнике или из крахмала зерновых культур. Pt
+ Н2 → СН3CH2ОН
3.Восстановлением карбоновых кислот и сложных эфиров (с использованием алюмгидрата лития -LiAlH4)
LiAlH4
RCOOH → RCH2OH
H+, Н2О
LiAlH4
С6Н5СООСН3 → С6Н5СН2ОН + СН3ОН
метилбензоат бензиловый спирт метанол
4. Гидратацией алкенов
H+,t0
CH2 =CH2+ Н2О → СН3CH2ОН
(в промышленности)
Частные реакции:
а) метанол - промышленный способ
из синтез – газа: СО + 2Н2 → CH3ОН
Р=5-10МПа, t0250-4000С,кат:СuO,Cr2O3, ZnO
б) этанол - гидролизом сахаров
ферменты ферменты
(С6Н11О5)n → С6Н12О6 → С2Н5ОН сахар глюкоза -СО2 спирт
Сахар извлекали из сахарной патоки, содержащейся в сахарном тростнике или из крахмала зерновых культур.
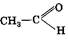  Запомни! Если в результате химической реакции образуется вещество, у которого при одном и том же атоме углерода находятся двойная связь и гидроксогруппа, то происходит перестройка молекулы:
H2C= CH →
|
ОН Запомни! Если в результате химической реакции образуется вещество, у которого при одном и том же атоме углерода находятся двойная связь и гидроксогруппа, то происходит перестройка молекулы:
H2C= CH →
|
ОН
|
Многоатомные спирты (полиолы).
Многоатомные спирты- органические соединения, производные углеводородов, содержащие несколько групп ОН связанных с разными атомами углерода.
| Классификация: а) двухатомные CH2-CH2 CH2- CH2-СН3 | | | | ОН ОН ОН ОН этандиол-1,2; пропандиол-1,2 этиленгликоль пропиленгликоль б) трехатомные CH2- CH- CH2 | | | ОН ОН ОН пропантриол-1,2,3; глицерин Физические свойства: - бесцветные вязкие сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль Значительно повышает температуру замерзания воды при растворении, это свойство используется для приготовления антифриза- низкозамерзающей жидкости, применяемой при охлаждении двигателей внутреннего сгорания и установок, работающих в условиях при температуре ниже 00С. Из этиленгликоля и терефталевой кислоты (НООС-С6Н14- СООН) получают волокно- лавсан Глицерин применяется в парфюмерии, пищевой промышленности (добавляет-ся в ликеры и кондитерские изделия), это исходное вещество для получения нитроглицерина, из которого изготовляют динамит. | Химические свойства | Получение |
Химические свойства сходные с одноатомными спиртами:
а) взаимодействие с Na c выделением водорода
б) взаимодействие с галогеноводородами
Реакции могут идти за счет одной или нескольких групп.
С увеличением числа гидроксильных групп усиливаются кислотные свойства.
Многоатомные спирты взаимодействуют со щелочами с образованием солей гликолятов и глицератов.
CH2-CH2 + 2NaOH→ CH2-CH2 + 2Н2О
| | | |
ОН ОН ОNa ОNa - гликолят натрия
Образуют сложные эфиры:
а) CH2 ОН CH2 О NO2
| Н2SO4(к) |
CH ОН + 3 HNO3 → CH О NO2 + 3Н2О
| |
CH2ОН СH2 О NO2
тринитрат глицерина
б) CH2 ОН CH2 О СOС17Н35
| Н+,t0 |
 CH ОН + 3 С17Н35СООН D CH О СOС17Н35 + 3Н2О
| |
CH2ОН СH2 О СOС17Н35
тристеарат глицерина (жир)
Качественная реакция на многоатомные спирты - взаимодействие со свежеосажденным гидроксидом меди (II) - ярко-синее окрашивание. CH ОН + 3 С17Н35СООН D CH О СOС17Н35 + 3Н2О
| |
CH2ОН СH2 О СOС17Н35
тристеарат глицерина (жир)
Качественная реакция на многоатомные спирты - взаимодействие со свежеосажденным гидроксидом меди (II) - ярко-синее окрашивание.
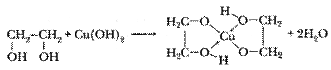
| I. Получение этиленгликоля:
1. Окислением алкенов (реакция Вагнера)
3CH2=CH2+ 2КMnO4 + 4Н2О→3СН2ОНCH2ОН + 2MnО2↓ + 2 КОН
2. Щелочной гидролиз 1,2 дигалогенэтана:
CH2 - CH2 + 2NaOHводн р-р → CH2-CH2 + 2NaCl | | | |
Cl Cl ОН ОН
3. Гидролиз этиленоксида – промышленный метод
  О2, Ag, 3000 O + Н2О, Н+
CH2=CH2 → CH2- CH2 → ОН- СН2- CH2 – ОН
этиленоксид
II. Получение глицерина:
а) промышленный способ:
Сl2,3000 HOCl 2OH-
CH2=CH-CH3 → CH2=CH-CH2Сl → ClСН2 – CHОН - CH2Сl → пропен аллилхлорид - 2Cl
→ СН2ОН-CHОН-CH2ОН
б) гидролиз жиров t0
С3Н5О3(СOС17Н35)3 + 3NaOH → 3С17Н35COONa + С3Н5(OH)3
Запомните: два или более гидроксила при одном атоме углерода являются весьма нестабильным сочетанием и в свободном виде такие соединения встречаются крайне редко. В случаях, когда подобное соединение должно образоваться в какой-либо реакции, оно перегруппировывается в альдегид или кетон.
OH O
| - Н2О ǁ О2, Ag, 3000 O + Н2О, Н+
CH2=CH2 → CH2- CH2 → ОН- СН2- CH2 – ОН
этиленоксид
II. Получение глицерина:
а) промышленный способ:
Сl2,3000 HOCl 2OH-
CH2=CH-CH3 → CH2=CH-CH2Сl → ClСН2 – CHОН - CH2Сl → пропен аллилхлорид - 2Cl
→ СН2ОН-CHОН-CH2ОН
б) гидролиз жиров t0
С3Н5О3(СOС17Н35)3 + 3NaOH → 3С17Н35COONa + С3Н5(OH)3
Запомните: два или более гидроксила при одном атоме углерода являются весьма нестабильным сочетанием и в свободном виде такие соединения встречаются крайне редко. В случаях, когда подобное соединение должно образоваться в какой-либо реакции, оно перегруппировывается в альдегид или кетон.
OH O
| - Н2О ǁ
 R1- C - R2 R1- C- R2
|
ОН
R1 и R2- алкил, водород R1- C - R2 R1- C- R2
|
ОН
R1 и R2- алкил, водород
|