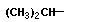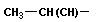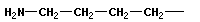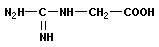СПИРТЫ
Спиртами называют алифатические соединения, содержащие гидроксильную группу (алканолы, алкенолы, алкинолы); гидроксиарены или ароматические гидроксипроизводные называются фенолами. Название спирта образуется прибавлением суффикса -ол к названию соответствующего углеводорода или на основе углеводородного радикала. В зависимости от строения углеводородного радикала различают спирты:
первичные: R-OH
| CH3OH | С2H5OH | xxxhhhрррC3H7OH | ||
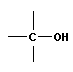
вторичные:
| R1 > CH-OH R2 | R1 = R2 = CH3 изопропиловый спирт изо-пропанол | |
третичные:
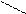 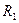
 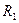 ---- C --- OH ---- C --- OH
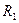
| R1 = R2 = R3 = CH3 трет-бутанол | |||
Одноатомные фенолы:
  OH OH
|  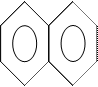 OH OH
|
| фенол | α-нафтол |
Фенолы характеризуются более сильными кислотными свойствами, чем спирты, последние в водных растворах не образуют карбониевые ионы AIk – O–, что связано с меньшим поляризующим действием (электроакцепторными свойствами акильных радикалов по сравнению с ароматическими).
Спирты и фенолы тем не менее легко образуют водородные связи, поэтому все спирты и фенолы имеют более высокие температуры кипения, чем соответствующие углеводороды.
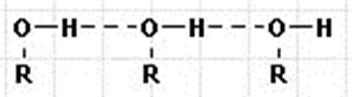
Соединения с двумя и более гидроксильными группами называются многоатомными спиртами и фенолами:
 СН2—ОН
СН2--ОН СН2—ОН
СН2--ОН
|  СН2—ОН
СН—ОН СН2—ОН
СН—ОН
 СН2--ОН СН2--ОН
| |
| 1,2-этандиол (гликоль) | 1,2,3-пропан-триол (глицерин) | |
================================================
АЛЬДЕГИДЫИ КЕТОНЫ window.top.document.title = "12.4.2. Альдегиды и кетоны";
Алканали (алифатические) и аренали (ароматические) альдегиды содержат функциональную группу 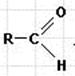 .
.
Название происходит от соответствующей карбоновой кислоты с добавлением «альдегид» или суффикса -аль к корню соответствующего углеводорода:
R = H – формальдегид, муравьиный альдегид, метаналь;
R = CH3 – ацетальдегид, уксусный альдегид, этаналь;
R = C6H5 – бензальдегид, фенилаль.
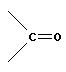
Кетоны содержат карбонильную группу и бывают симметричными (R1 = R2) и несимметричными (R1 ≠ R2): R1 = R2 = CH3 – диметилкетон (ацетон); R1 = CH3, R2 = C2H5 – метилэтилкетон. В названии кетона используют оба углеводородных радикала или добавляют суффикс -он к соответствующему углеводороду: ацетон, диметилкетон, диметилкарбон, пропан-2-он.
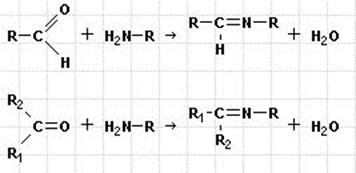
Специфической реакцией альдегидов и кетонов является образование азометиновых соединений (оснований Шиффа) с первичными аминами:
ЭФИРЫ window.top.document.title = "12.4.4. Эфиры";
Сложные эфиры содержат группировку
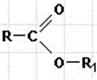
При этом R и R1 могут быть одинаковыми или разными.
Сложные эфиры образуются в результате реакции этерификации:
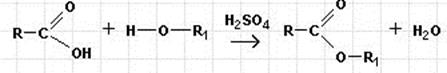
Название начинается с радикала спирта и заканчивается названием кислоты с добавлением суффикса -ат.
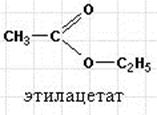
Под действием кислот, а особенно оснований, идет обратная реакция гидролиза (омыления). Сложные эфиры относятся к органическим растворителям. Взаимодействие дикарбоновой кислоты с диолом приводит к образованию полиэфиров (полимеров):
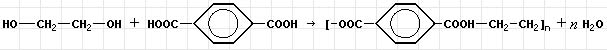
Простые эфиры содержат группировку R–O–R1. Получаются они отщеплением воды от двух молекул спирта:
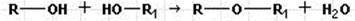
При R = R1 эфир называется симметричным, если радикалы разные – несимметричным. Название – по радикалам с добавлением слова «эфир»:
C2H5–O–C2H5 – диэтиловый эфир, C2H5–O–CH3 – метилэтиловый эфир.
КАРБОНОВЫЕ КИСЛОТЫ window.top.document.title = "12.4.3. Карбоновые кислоты";
Карбоновые кислоты  содержат карбоксильную группировку –COOH. Свойства кислоты определяются природой радикала R, обычно это слабые кислоты, pH = 4–5. Название происходит от соответствующего углеводорода с добавлением окончания «-вая кислота» или окончания «-карбоновая кислота» к углеводороду на один атом меньше:
содержат карбоксильную группировку –COOH. Свойства кислоты определяются природой радикала R, обычно это слабые кислоты, pH = 4–5. Название происходит от соответствующего углеводорода с добавлением окончания «-вая кислота» или окончания «-карбоновая кислота» к углеводороду на один атом меньше:
R = H – метановая кислота, муравьиная кислота;
R = CH3 – этановая кислота, метанкарбоновая кислота, уксусная кислота;
R = C2H5 – пропановая кислота, этанкарбоновая кислота, пропионовая кислота;
R = C6H5 – бензойная кислота, фенилкарбоновая кислота.
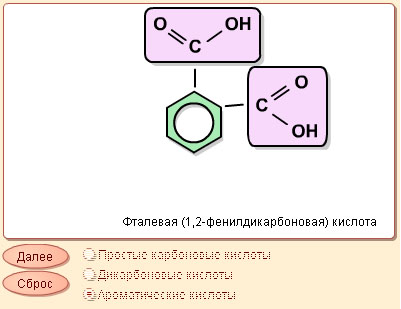
|
| Карбоновые кислоты. |
Большое значение в биохимии имеют дикарбоновые кислоты: алифатические насыщенные HOOC–(CH2)n–COOH (n = 0, 1, 2,...), алифатические ненасыщенные (HOOC)2CnH2n–2 (n = 2, 3, 4,...), ароматические C6H4(COOH)2.
В растворах кислоты диссоциируют:
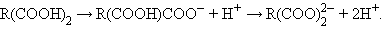
|
Карбоновые кислоты в свободном состоянии и в растворах склонны к димеризации или ассоциации за счет сильной водородной связи.
ОКСИКИСЛОТЫ window.top.document.title = "12.5.1. Оксикислоты";
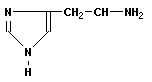
Оксикислоты характеризуются наличием в молекуле кроме карбоксильной еще гидроксильной группы О–Н, их общая формула R(OH)n(COOH). Формально простейшей оксикислотой будет хорошо известная неорганическая угольная кислота (оксометановая кислота). Поскольку функции двух О–Н-групп, связанных с одним атомом углерода, одинаковы, то любая из них может входить в карбоксильную группировку и диссоциировать по механизму двухосновной кислоты. Собственно первым представителем органических оксикислот будет оксиэтановая кислота (оксиуксусная, оксиметанкарбоновая, гликолевая кислота).
Наиболее важными из оксикислот, участвующих в процессах жизнедеятельности, являются:
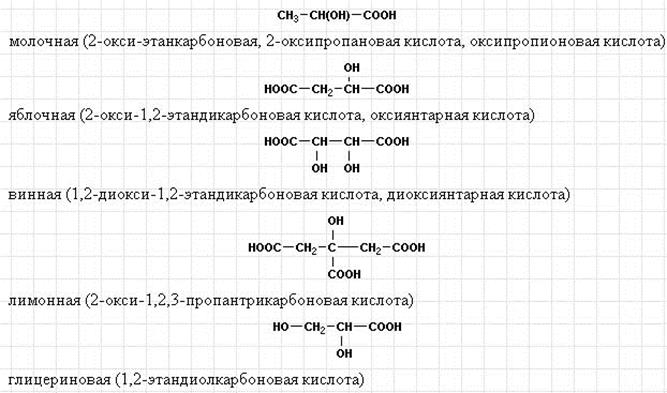
АЛЬДЕГИДО- И КЕТОНОКИСЛОТЫ window.top.document.title = "12.5.2. Альдегидо- и кетонокислоты";
Альдегидо- и кетонокислоты содержат наряду с карбоксильной  соответственно альдегидную
соответственно альдегидную 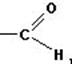 и кетонную (карбонильную)
и кетонную (карбонильную) 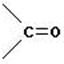 группировки.
группировки.
При окислении гликолевой кислоты НООС-СН2ОН получается единственно возможная α-альдегидокислота-глиоксалевая НООС-СНО, содержащаяся в недозрелых фруктах. Дальнейшее окисление приводит к образованию щавелевой кислоты НООС-СООН. Простейшая известная кетонокислота – пировиноградная СН3—СО—СООН (α-кетонопропионовая, этан-2-он-карбоновая кислота) – может быть получена окислением молочной кислоты
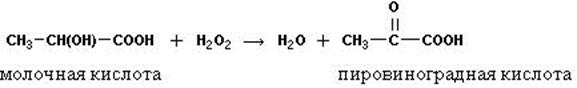
или омылением α-дибромпропионовой кислоты
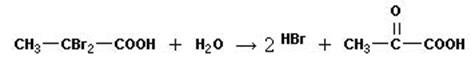
АМИНЫ window.top.document.title = "12.4.5. Амины";
Амины – производные аммиака, поэтому известны три типа аминов, в которых атомы водорода последовательно замещены алкильными радикалами R:
Первичные вторичные третичные
RNH2 R2NH R3N
Амины – слабые основания, поскольку азот всегда остается донором электронной пары. Первичные амины реагируют с альдегидами и кетонами с образованием группировки R'HC=N–R или RR'C=N–R'' (основания Шиффа).
НИТРИЛЫИ НИТРОСОЕДИНЕНИЯ window.top.document.title = "12.4.7. Нитрилы и нитросоединения";
Нитрилы содержат нитрильную группировку R–C≡N, при гидролизе которой получаются карбоновые кислоты:
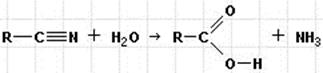
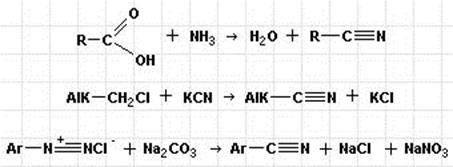
Нитрилы, таким образом, могут быть получены из кислот, галогеналканов, а ароматические – из солей диазония.
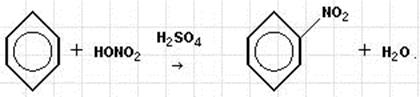
Нитросоединения содержат группу –NO2 и получаются нитрованием органических веществ смесью концентрированных азотной и серной кислот:
При частичном восстановлении получаются нитрозосоединения
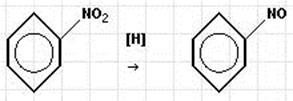
Конечным продуктом восстановления будет анилин (аминобензол); реакция Зинина.
СЕРОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ window.top.document.title = "12.4.8. Серосодержащие соединения";
В серосодержащих соединениях обычно кислород замещается на серу, образуя
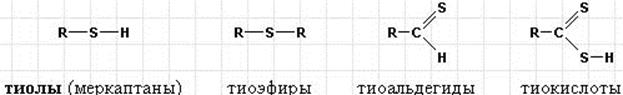
В названии обычно фигурирует приставка тио- (тиоспирты, тиоальдегиды, монотио- и диотиокислоты). Тиопроизводные обладают более сильными кислотными свойствами и очень неприятным запахом; некоторые очень токсичны.
Сульфокислоты содержат –SO2OH, получаются взаимодействием органического вещества с серной кислотой.
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ window.top.document.title = "12.4. Функциональные производные углеводородов";
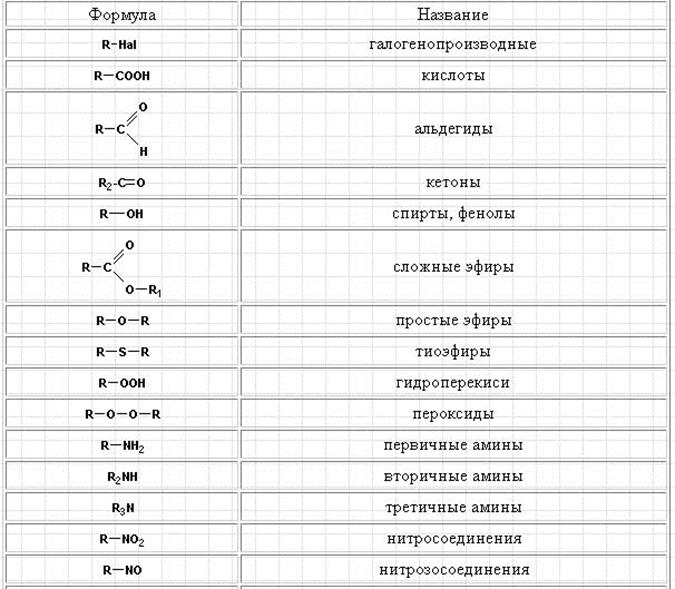
Свойства любого органического соединения, получаемого путем замещения атома водорода в данной молекуле (остаток молекулы после отнятия атома водорода называется радикалом R) на гетероатом (Cl, Br и т. д.) или функциональную группу с одним (OH, NH2) или несколькими (COOH, SO3H, NO2) гетероатомами, определяются природой заместителя или функциональной группы. Обычно такие производные углеводородов записываются в виде R–Y (где Y – гетероатом или функциональная группа), см. табл. 12.7.

Углеводы window.top.document.title = "13.1. Углеводы";
Углеводы с общей формулой 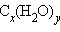 – это полиспирты, содержащие альдегидную
– это полиспирты, содержащие альдегидную 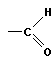 или кетонную
или кетонную 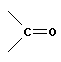 группировку.
группировку.
Следующая схема наглядно показывает генеалогию углеводов (сахаридов):
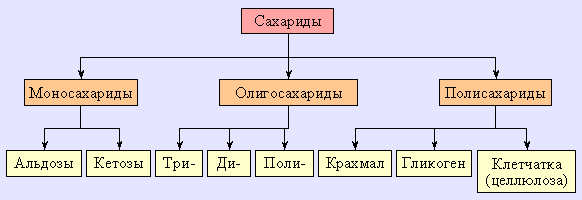
|
| Рисунок 13.1. |
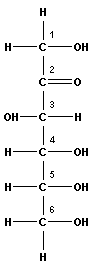
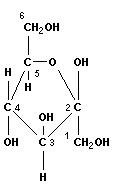
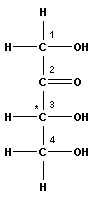
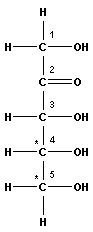
В молекуле моносахарида для указания числа углеродных атомов к корню соответствующего греческого числительного прибавляют окончание «- оза ».
Моносахариды обычно изображаются формулами Фишера, в которых углеродная цепь располагается линейно. В табл. 13.1 приведены первые четыре типа моносахаридов.
|
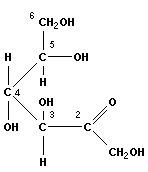
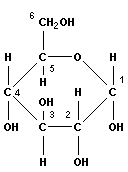
Циклизация кетогексозы (фруктозы) приводит к образованию пятичленного фуранового цикла:
| 
| 
| 
| |
| фруктоза (кетогексоза) | фруктоза | фруктофураноза |
При образовании циклической структуры группа ОН, связанная с C1, может расположиться по ту же сторону от кольца, что и ОН-группа, связанная с C2 (α-форма) или по противоположную сторону кольца (β-форма), что играет существенную роль при образовании полисахаридов.
При связывании двух моносахаридов по реакции конденсации образуются дисахариды с возникновением гликозидной связи:
| + | 
| 
| 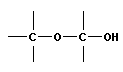
|
| гликозидная связь |
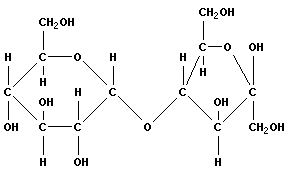
При конденсации глюкозы и фруктозы образуется дисахарид сахароза (пищевой сахар).
| + | 
| 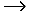
| 
| + | 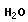
|
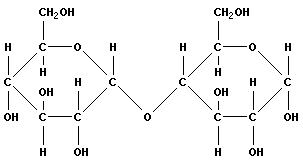
В зависимости от места образования гликозидной связи различают несколько дисахаридов: тип сахарозы (α-1,2-связь), тип мальтозы (α-1,4-связь), тип лактозы (β-1,4-связь):
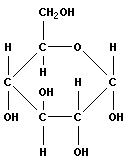
| + | 
| 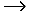
| 
| (тип α-1,4) |
| глюкоза | глюкоза | мальтоза (солодовый сахар) |
| (тип β-1,4) |
| остаток глюкозы остаток глюкозы | |
| лактоза (молочный сахар) |
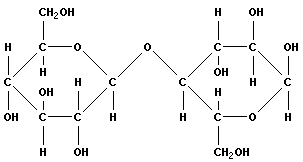
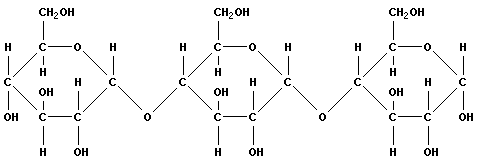
Полисахариды – высокомолекулярные соединения общей формулы (C6H10O5) n. Важнейшими представителями этих высших полиоз являются крахмал, гликоген, целлюлоза.
Крахмал – полиоза растительного происхождения, состоящая из двух фракций – амилозы и амилопектина, соотношение между которыми колеблется в пределах 1:9 – 1:4. Отличие между амилозой и амилопектином заключается в том, что в амилопектинах помимо α-1,4-гликозидной связи имеются разветвления по α-1,6-связи. Поскольку α-1,4-гликозидная связь типична для мальтоз, то гидролиз крахмала обычно происходит по схеме
| (C6H10O5) n | → | (C6H10O5) n | → | C12H22O11 | → | C6H12O6. |
| крахмал | декстины, растворимые крахмалы | мальтоза | глякоза |
Гликоген (животный крахмал) играет роль резервного полисахарида. Конечным продуктом сложных превращений гликогена в мышцах является молочная кислота.
Гликозидные цепи α-1,4-типа в молекуле гликогена более разветвлены по связи α-1,4-типа, поэтому их молекулярный вес достигает 1∙106 единиц.
Клетчатка (целлюлоза) – полисахарид, среднее число гликозидных фрагментов β-1,4-типа в которых достигает 6000–12000.
Инулин – резервный полисахарид растений, гидролизуется во фруктозу.
Структура молекул крахмала и целлюлозы приведена ниже:
крахмал
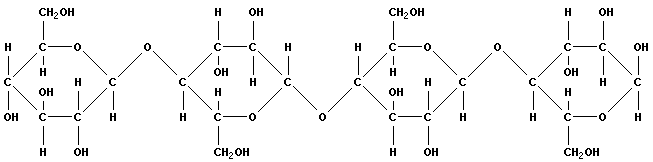
целлюлоза
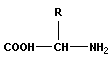
АМИНОКИСЛОТЫ window.top.document.title = "13.3. Аминокислоты";
Аминокислоты (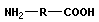 ) диссоциируют в растворе с pH 4–9 с образованием катион-аниона (цвиттер-иона):
) диссоциируют в растворе с pH 4–9 с образованием катион-аниона (цвиттер-иона):
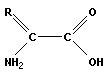

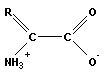
В составе белков встречается до 25 аминокислот, но только десять из них не синтезируются живым организмом. Это так называемые незаменимые аминокислоты (табл. 13.2).
| |||||||||||||||||||||||||||||||||
| Незаменимые аминокислоты. |
Большинство аминокислот содержат асимметрический атом углерода и проявляют оптические свойства. Как правило, в процессах жизнедеятельности участвуют α-изомеры; β-изомеры очень редки и обнаружены лишь в некоторых видах бактерий, антибиотиках грамицидине и актиномицине. Оптически не активна α-аминоуксусная кислота
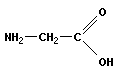 глицин (Gly)
глицин (Gly)
ПОЛИПЕПТИДЫ window.top.document.title = "13.4. Полипептиды";
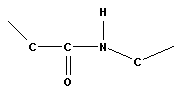
При взаимодействии аминогруппы одной и карбоксильной группы другой α-аминокислот возникает амидная или пептидная связь. В основе образования пептидной связи лежит реакция конденсации
 +
+ 
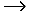
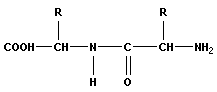 +
+ 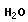
В пептидной группировке π-электроны делокализованы, что создает возможность для образования двух изомерных форм:
| 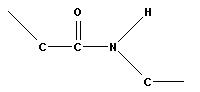
| |
| транс- | цис- |
Более устойчива транс-форма, именно она присутствует в натуральных белках.
Валентные углы и межатомные расстояния во всех пептидных группировках практически постоянны, но зависят от природы расположенных по бокам пептидной цепи радикалов R.
В названии пептида слева указывается аминокислота со свободной аминогруппой (N – концевая аминокислота), справа – аминокислота со свободной карбоксильной группой (C – концевая аминокислота).
БЕЛКИ window.top.document.title = "13.5. Белки";
Белки – высокомолекулярные соединения, образующиеся в результате связывания отдельных полипептидных цепей водородными связями. Все белки подразделяются на глобулярные и фибриллярные. Глобулярные белки компактны, обладают сферической и приближенными к ней формами. Глобулярный белок диаметром 2,5 нм представляет собой полипептидную цепь длиной до 50 нм, свернутую в клубок. Фибриллярные белки обычно вытянуты и входят в состав тканей, мышц, волос. Полипептидные цепи такого белка, свернутые в винтовую спираль, ориентированы параллельно друг другу. На рис. 13.3 приведена структура нити мышечного белка. Одной из важнейших вторичных структур является α-спираль, впервые найденная Л. Полингом и Р. Б. Кори.
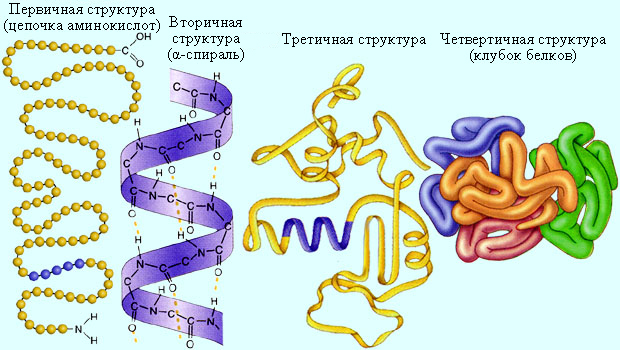
|
| Структура нити мышечного белка. |
Белковую природу имеют многочисленные ферменты, которые катализируют реакции определенного типа. Ферментам свойственна высокая избирательность, наибольшая активность при нормальной температуре организма, зависимость ферментной активности от pH. Ферменты разделяются на шесть классов:
1. Оксидоредуктазы – катализируют окислительно-восстановительные процессы.
2. Трансферазы – катализируют перенос химических групп (радикалов).
3. Гидролазы – катализируют гидролитические процессы.
4. Лиазы – обеспечивают присоединение по двойным связям или их образование.
5. Изомериазы – участвуют в процессах изомеризации.
6. Синтетазы – обеспечивают реакции конденсации двух молекул с участием фосфатных групп.
Для обеспечения каталитической функции многие ферменты содержат в молекуле небелковую часть – кофактор. Кофакторами могут быть органические вещества или ионы биометаллов, а также 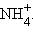
НУКЛЕИНОВЫЕ КИСЛОТЫ window.top.document.title = "13.6. Нуклеиновые кислоты";
Нуклеиновые кислоты – биосополимеры, состоящие из пуринового или пиримидинового основания, углеводов (рибозы и дезоксирибозы) и фосфатных групп; они входят в состав клеточного ядра (nucleus), отсюда их название – нуклеотиды.
Пуриновые основания: аденин и гуанин:
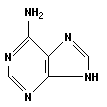
| 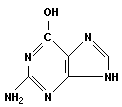
| |
| аденин (А) | гуанин (Г) |
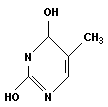
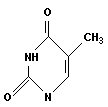
Пиримидиновые основания: цитозин, урацил, тимин:
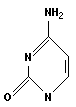
| 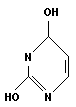  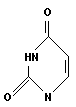
|   
| ||
| цитозин (Ц) | урацил (У) | тимин (Т) |
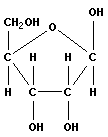
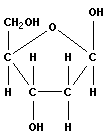
В состав мононуклеотидов обычно входят D-рибоза (в форме β-D-рибофуранозы), глюкоза (редко) и β-D-2-дезоксирибоза:
| 
| |
| β-D-рибоза | β-D-дезоксирибоза |
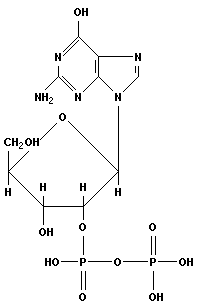
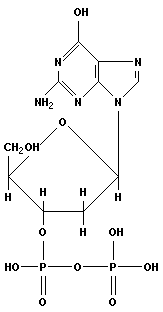
Пуриновые или пиримидиновые основания, рибоза и дезоксирибоза, а также фосфорная кислота связаны в молекулах нуклеотидов однотипно. Пентозы, с одной стороны, посредством одного углеродного атома соединяются с соответствующим основанием: с пуриновым по его 9-му атому азота, с пиримидиновым – по 3-му атому азота, а с другой – эфирной связью соединяются с монофосфорной, дифосфорной или трифосфорной кислотами, образуя соответствующие мононуклеотиды. Последние за счет конденсации ОН-групп фосфорных кислот и пентозов полимеризуются в РНК и ДНК.
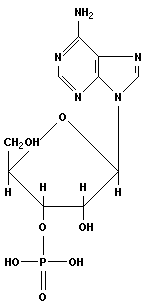
| 
| |
| аденозин-1-рибо-3-монофосфат (АМФ) | гуанозин-1-рибо-2-дифосфат (ГДФ) |
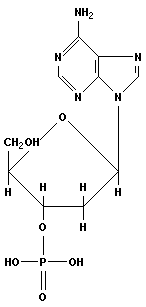
| 
| |
| аденозин-1-дезокси-3-монофосфат (АДФ) | β-D-гуанозин-1-дизокси-3-трифосфат (ГДФ) |
На рис. 13.4 приведена структура полинуклеотида. Линейный полинуклеотид образует двойную спираль ДНК (рис. 13.5).
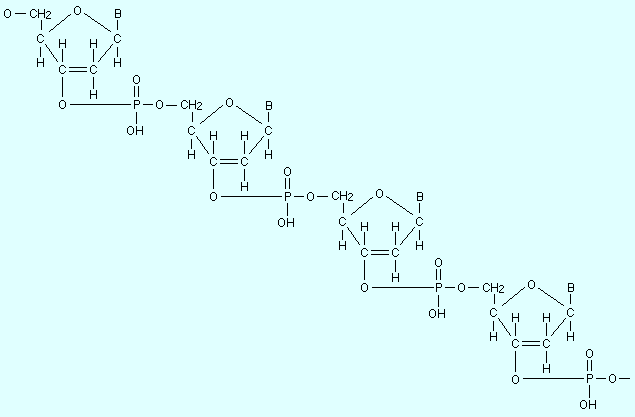
|
| Структура полинуклеотида. B – любое из пириновых или пиримидиновых оснований. |
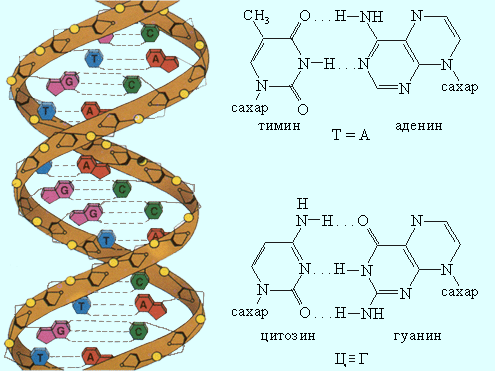
|
| Схематическое образование комплементарных (взаимодополняющих) пар оснований и двойной спирали ДНК. |
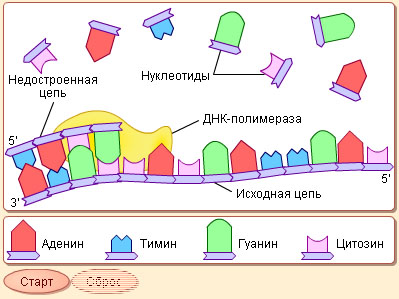
|
| Построение комплементарной цепи ДНК. |
ВИТАМИНЫИ ГОРМОНЫ window.top.document.title = "13.7. Витамины и гормоны";
Витамины – биохимически активные низкомолекулярные органические и биокоординационные соединения, необходимые для обеспечивания жизненно важных функций организма. Недостаток того или иного витамина приводит к тяжелым заболеваниям. Известны около 20 соединений, относимых к витаминам. Витамины делятся на водо- и липидорастворимые и относятся к нескольким группам, обозначаемым прописными буквами латинского алфавита A, B, C, D, E, K.
Витамины группы А – производные 4-(2',2',6-триметилгексен-1')-бутен-3-ОН-2.

|
| Особенно богата морковь каротином – провитамином А, который образно называют «витамином роста». |
Они образуются только в животных организмах, но из предшественников, синтезируемых растениями. Такие каротиноподобные провитамины содержатся в шпинате, моркови. Витамины группы А содержатся в молочных продуктах, животном жире, яйцах, но особенно много их в рыбьем жире. Наиболее важные витамины группы А – ретинол (А1), ретиналь (A1-альдегид), ретиноевая кислота (A2) и др.
Первым из витаминов был открыт витамин B, а в 1926 г. была установлена его структура.
Витамины группы B – азотсодержащие гетероциклические соединения, отвечающие за процессы роста (B1, B2), нормальное развитие кожи (B6), кроветворную способность (B12). Простейшим является 3-пиридинкарбоновая кислота (иногда называемый PP), наиболее сложным – B12, относящийся к биокоординационным соединениям.
Хорошо известный витамин C – аскорбиновая кислота – относится к группе витаминов C – производных L-гулоновой кислоты. Собственно витамин C в лактонном виде имеет формулу
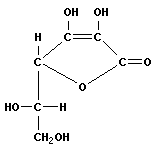
Эта группа витаминов обладает многофункциональным действием (наиболее известное – противоцинготное).
Витамины группы D препятствуют развитию рахита. Некоторые из них могут синтезироваться из веществ-предшественников в коже под действием солнечного света, другие поступают с пищей.
Витамины группы E регулируют процессы размножения, а витамины группы K – свертываемость крови.
Гормоны вырабатываются железами внутренней секреции (эндокринными) и регулируют обменные процессы в организме.
Известно более 40 гормонов, объединяемых в три группы: производные аминокислот, пептидные и стероидные. К первой относятся адреналин, ко второй инсулин, к третьей – мужские (производные андростана R = CH3) и женские (производные эстрона R = H) половые гормоны:
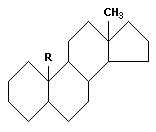
К стероидам относится холестерин
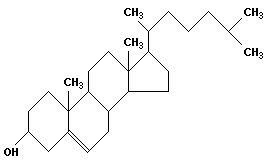
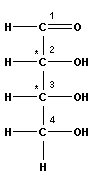
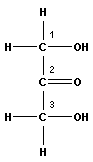
 рибоза
рибоза
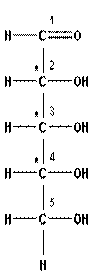
 глюкоза
глюкоза
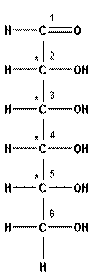
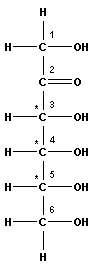 фруктоза
фруктоза