Растворимостью называется способность того или иного вещества растворяться в том или ином растворителе. Раствор, находящийся в равновесии с растворяемым веществом, называется насыщенным, а концентрация такого раствора – растворимостью. Растворы с меньшей концентрацией, чем в насыщенном, называются ненасыщенными, с большей – пересыщенными.
Растворимость большинства веществ уменьшается с понижением температуры и при охлаждении горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если охлаждение производить осторожно и медленно, исключив попадание твердых частиц извне, то выделение вещества из раствора может и не произойти. Получается раствор, содержащий значительно больше растворенного вещества, чем требуется для насыщения при данной температуре.
Растворимость веществ зависит от их природы, природы растворителя, а также от внешних условий (давления, температуры и т. д.) и колеблется в значительных пределах. Некоторые вещества неограниченно растворимы друг в друге (вода–ацетон, вода–спирт, бензол–толуол). Большинство соединений ограниченно растворимы (вода–бензол, вода–бутиловый спирт, вода–поваренная соль), а многие малорастворимы или практически нерастворимы (вода–BaSO4, вода–бензин), но абсолютно нерастворимых веществ нет.
Контрольные вопросы и задачи
1 Что понимается под раствором?
2 В чем проявляется особенность жидких растворов?
3 Что показывает массовая доля (аналогично: молярная, эквивалентная, моляльная концентрации, молярная доля, титр), ее размерность? Существуют ли пределы числовых значений для этой концентрации (если да, то какие)? Запишите формулу для ее вычисления и поясните ее.
4 Что понимается под растворимостью? Чем она выражается? Как влияет давление и температура на растворимость газа и твердого вещества в жидкости?
5 Какие растворы называются насыщенными, ненасыщенными, пересыщенными?
Задача 1. На нейтрализацию 31 см3 0,16 н раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны нормальность и титр раствора H2SO4?
Задача 2. Смешали 10 см3 10-процентного раствора HNO3
(r = 1,056г/см3) и 100 см3 30-процентного раствора HNO3 (r = 1,184 г/см3). Вычислите массовую долю азотной кислоты в полученном растворе.
Задача 3. Из 400 г 50-процентного по массе раствора серной кислоты выпариванием удалили 100 г воды. Чему равна массовая доля и моляльная концентрация кислоты в полученном растворе?
Задача 4. Из 400 г 20-процентного (по массе) раствора при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
Задача 5. Плотность 40-процентного раствора гидроксида калия
1,4 г/см3. Сколько граммов гидроксида потребуется для приготовления
500 мл 40-процентного раствора? Какова нормальная концентрация этого раствора?
Задача 6. Чему равны нормальность и титр 30-процентного раствора гидроксида натрия плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора.
Задача 7. К 3 л 10-процентного раствора азотной кислоты, плотность которого 1,054 г/см3, прибавили 5 л 2-процентного раствора азотной кислоты с плотностью 1,009 г/см3. Вычислите процентную, моляльную и молярную концентрации полученного раствора, если считать, что его объем равен 8 л.
Свойства растворов неэлектролитов
Неэлектролиты – это вещества, растворы которых не проводят электрический ток. В растворенном состоянии они сохраняют молекулярную структуру. Как правило, это органические соединения (спирт, глюкоза, камфора, бензол и т. д.).
Некоторые свойства раствора зависят от числа частиц (атомов, молекул, ионов) в нем и не зависят от его состава. Такими свойствами, которые называются коллигативными, обладают разбавленные растворы неэлектролитов, концентрация которых не более чем 0,2 моль/л. К коллигативным свойствам относятся понижение давления пара, понижение температуры замерзания, повышение температуры кипения растворителя в присутствии в нем растворенного вещества, осмотическое давление.
Понижение давления пара
Рассмотрим двухкомпонентный раствор, свойства которого близки к идеальному. Это означает, что между компонентами раствора практически отсутствует взаимодействие. Пусть растворитель – летучее вещество, растворенный в нем неэлектролит – нелетучее.
Равновесное состояние между жидкостью и паром характеризуется давлением насыщенного пара. Пусть давление насыщенного пара над чистым растворителем – р0, а давление насыщенного пара над раствором – р.
Молекулы нелетучего растворенного компонента препятствуют улетучиванию из раствора молекул растворителя (какая-то часть поверхности просто занята ими), т. е. р0 > р. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре.
Понижение давления пара над раствором находит отражение на диаграмме состояния.
Поясним, что такое диаграмма состояния. На ней отображены области существования твердой, жидкой и газообразной фаз вещества (в данном случае воды) в зависимости от температуры Т и давления Р. Кривая О–А – кривая кипения, отделяет область газа от области жидкого состояния. Каждая точка кривой показывает пары значений Р и Т, при которых жидкость и газ находятся в состоянии равновесия. Кривая О–В – кривая равновесия твердого состояния и газообразного или кривая сублимации. Кривые пересекаются в точке О. Координаты этой точки – это единственная пара значений Р и Т, при которой в равновесии могут находится все три фазы. Она носит название тройной точки и соответствует температуре плавления или кристаллизации.
На рисунке 1 изображена Р–Т-диаграмма воды, на которой нанесены линии зависимости давления пара воды над растворами различной концентрации. Линия О–Асоответствует давлению пара над чистой водой, а линия О*–А* – давлению пара воды над раствором с концентрацией С1.Согласно первому закону Рауля, при одной и той же температуре давление пара над раствором меньше на величину  . При увеличении концентрации растворенного вещества (С2 > С1)давление продолжает понижаться, линия О**–А** лежит ниже линии О*–А*.
. При увеличении концентрации растворенного вещества (С2 > С1)давление продолжает понижаться, линия О**–А** лежит ниже линии О*–А*.




Рисунок 1 – Диаграмма состояния воды и растворов неэлектролитов
2.2 Повышение температуры кипения, понижение температуры замерзания растворов. Второй закон Рауля
Из графика (см. рисунок 1)видно, что температура кипения раствора выше температуры кипения чистого растворителя. Под температурой кипения подразумевается та температура, при которой давление насыщенного пара равно внешнему давлению. Поэтому она различна: для чистой воды – это температура Т1, а для раствора – Т2.
Для разбавленных растворов при понижении температуры (см. рисунок 1)первым начинает кристаллизоваться чистый растворитель. Это происходит тогда, когда давление пара над раствором станет равно насыщенному пару над кристаллом (линия О–В). Температура начала кристаллизации для раствора состава С1соответствует температуре Т3, а для состава С2–Т4. При увеличении концентрации растворенного вещества температура замерзания уменьшается, что также хорошо видно на
Р–Т-диаграмме (см. рисунок 1).
Изучая замерзание и кипение растворов, Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора.
Второй закон Рауля: повышение температуры кипения (понижение температуры замерзания) раствора, по сравнению с температурой кипения (замерзания) растворителя, пропорционально моляльной концентрации растворенного вещества:
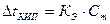 ;
;
 ,
,
где КЭ – эбулиоскопическая (от лат. ebullire – кипеть) постоянная растворителя;
ККР – криоскопическая (от греч. сrios – холод) постоянная растворителя;
 – повышение температуры кипения;
– повышение температуры кипения;
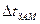 – понижение температуры замерзания;
– понижение температуры замерзания;
Сm – моляльная концентрация растворенного вещества.
Если расписать Сm, то формулы примут вид:
 ;
;
 .
.
Физический смысл эбулиоскопической и криоскопической постоянных определяется следующим образом. Их числовые значения показывают, на сколько градусов выше кипит и на сколько градусов ниже замерзает одномоляльный раствор (содержащий 1 моль растворенного вещества в 1000 г растворителя) по сравнению с температурами кипения и замерзания чистого растворителя. Единицы измерения – 1 град · моль–1 · кг.
Эбулиоскопическая и криоскопическая константы не зависят от природы растворенного вещества, а являются характеристиками растворителя. Их значения для некоторых растворителей приведены в таблице 1.
На измерениях температур кипения и замерзания растворов основаны эбулиоскопический и криоскопический методы определения молекулярных масс веществ. Эти два метода широко используются в химии, так как, применяя различные растворители, можно определять молекулярные массы разнообразных веществ.
Способность растворов замерзать при более низкой температуре, чем растворитель, используется при приготовлении низкозамерзающих растворов, которые называются антифризами. Ими заменяют воду в радиаторах автомобильных и авиационных моторов в зимнее время. В качестве основных компонентов могут быть использованы так называемые многоатомные спирты – этиленгликоль и глицерин. Водный раствор этиленгликоля (58-процентный по массе), например, замерзает только при температуре минус 50 °С.
Таблица 1 – Криоскопические и эбулиоскопические константы некоторых растворителей
| Растворитель | tКИП, °С | КЭ, град∙моль–1∙кг | tЗАМ, °С | ККР, град∙моль–1∙кг |
| Вода Н2О | 0,52 | 1,86 | ||
| Бензол С6Н6 | 80,1 | 2,53 | 5,5 | 5,12 |
| Хлороформ СНСl3 | 61,7 | 3,63 | –63,5 | 4,70 |
| Сероуглерод СS2 | 46,2 | 2,34 | –111,5 | 3,83 |
| Тетрахлорид углерода ССl4 | 76,5 | 5,03 | –23 |
Примеры решения задач
Перед решением задач следует уяснить следующее:
– температура замерзания раствора ниже температуры замерзания растворителя:
 ;
;
– температура кипения раствора выше температуры кипения растворителя:
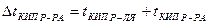 ;
;
– величина  всегда положительная и изменения температуры по шкале Цельсия
всегда положительная и изменения температуры по шкале Цельсия  и термодинамической шкале Кельвина
и термодинамической шкале Кельвина  численно совпадают, т. е.
численно совпадают, т. е.  и
и  .
.
Пример 1. Определение температуры кипения и температуры замерзания неэлектролита.
Определите температуру кипения и температуру замерзания
2-процентного раствора нафталина С10Н8 в бензоле.
Решение
На основании второго закона Рауля можно записать следующее:
 .
.
Значение эбулиоскопической константы бензола, а также температуры кипения и замерзания бензола возьмем из таблицы 1. М (С10Н8) = 128 г/моль. Вспомним, что процентная концентрация показывает число граммов растворенного вещества в 100 г раствора, значит, масса нафталина – 2 г, а масса растворителя, т. е. бензола, 100 – 2 = 98 г. Тогда, подставив известные величины в уравнение, получим
 ° С.
° С.
Поскольку чистый бензол кипит при 80,1 °С, а повышение температуры составляет 0,4 °С, то температура кипения раствора нафталина в бензоле – 80,5 °С.
Температура замерзания этого раствора определяется таким же образом:
 °С.
°С.
Температура замерзания бензола 5,5 °С. Понижение температуры составляет 0,8 град, следовательно, температура замерзания 2-процентного раствора нафталина в бензоле 4,7 °С.