Спирты
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. В общем виде молекулу спирта можно представить как ROH.
Классификация:
1) в зависимости от количества гидроксильных групп в молекуле на одноатомные (I) и многоатомные (II, III);
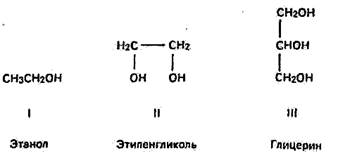
2) по характеру углерода, к которому присоединяется гидроксильная группа на первичные (I), вторичные (II) и третичные (III);
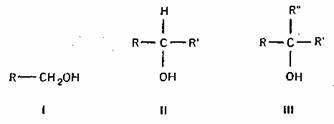
3) по характеру углеводорода на: а) алифатические — углеводород представлен в виде цепочки неразветвленной (I) или разветвленной (II);
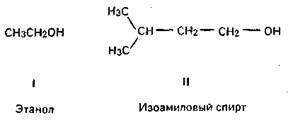
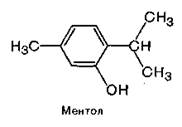
б) циклические — гидроксильная группа замещает атом водорода в циклическом углеводороде.
Спирты имеют нейтральную реакцию и реагируют с щелочными металлами с выделением диводорода:
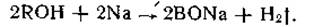
Образуют с кислотами сложные эфиры:
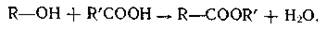
Первичные и вторичные спирты легко окисляются. При окислении первичных спиртов (I) образуются альдегиды, при окислении вторичных (II)—кетоны.
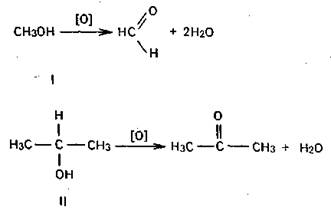
Третичные спирты окисляются с большим трудом.
Спирт этиловый 95 %
Spiritus aethylicus 95 %
С2Н5ОН М. м. 46,07
Получение. Спирт этиловый может быть получен из природных соединений и синтетически. В первом случае он получается в результате брожения сахаристых веществ. Полисахариды под влиянием ферментов превращаются в сахар — мальтозу (I), которая в свою очередь расщепляется до глюкозы (II):
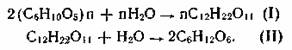
Конечным продуктом брожения глюкозы является этиловый спирт, или этанол:
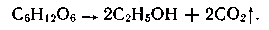
Этиловый спирт может быть получен синтетически из непредельных соединений:
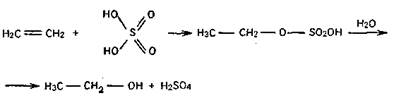
1) из этилена при действии на него серной кислоты. Последняя присоединяется к этилену, образуя серноэтиловый эфир, который при действии воды расщепляется на этанол и серную кислоту;
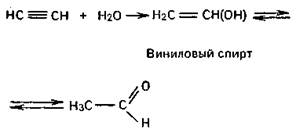
2) ацетилена по реакции Кучерова. Способ заключается в каталитическом гидрировании уксусного альдегида, который в свою очередь получается из ацетилена.
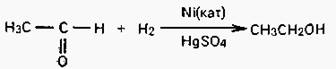
Уксусный альдегид отгоняется и восстанавливается диводородом в присутствии катализатора (никель, сульфат ртути и др.), при этом получается этиловый спирт.
Этиловый спирт — прозрачная жидкость. Он летуч, легко воспламеняется, имеет характерный запах, жгучий вкус; горит синеватым, слабо светящимся пламенем, смешивается во всех отношениях с водой, эфиром, хлороформом, ацетоном и глицерином.
Определение подлинности. Подлинность этилового спирта устанавливается следующими реакциями:
1) образованием йодоформа при взаимодействии с раствором иода в щелочной среде:
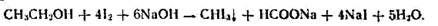
Реакция чувствительная, но недостаточно специфичная для этилового спирта, ее дают также соединения, имеющие в молекуле этоксильную группу ОС2Н5, ацетогруппу 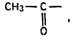 например ацетон, некоторые оксикислоты;
например ацетон, некоторые оксикислоты;
2) образованием сложных эфиров с кислотами. При взаимодействии этилового спирта с ледяной уксусной кислотой в присутствии концентрированной серной кислоты образуется уксусно-этиловый эфир, обладающий своеобразным запахом:
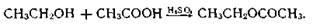
3) окислением спирта: а) дихроматом калия в присутствии серной кислоты с образованием ацетальдегида с характерным запахом свежих яблок.
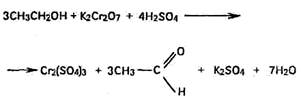
При этом жидкость будет окрашена в зеленый цвет, вследствие образования Cr2(SO4)3;
б) перманганатом калия в присутствии серной
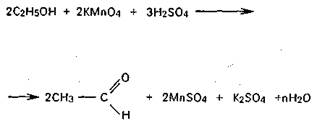
кислоты. Образующийся ацетальдегид, как и в первом случае, можно определить органолептически, а также химическими реакциями:
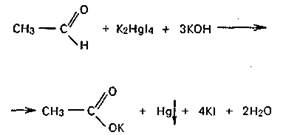
— с нитропруссидом натрия Na2[Fe(CN)5NO] в среде пиридина — на фильтровальной бумаге, смоченной этим реактивом возникает синее пятно;
— с реактивом Несслера в щелочной среде образуется черное пятно Hg на фильтровальной бумаге, пропитанной данным реактивом.
Количественное определение содержания этанола проводится с помощью пикнометра, позволяющего измерить плотность этилового спирта. В зависимости от концентрации этанола величина плотности различна. Чем меньше концентрация этанола, тем величина плотности больше. В ГФ приводятся таблицы зависимости плотности от концентрации этанола (алкоголеметрические таблицы).
Применение. По фармакологическим свойствам спирт этиловый относится к веществам наркотического действия.
Является протолитическим ядом!
В медицинской практике спирт применяют обычно как наружное антисептическое, дезинфицирующее и раздражающее средство.
Альдегиды
Для альдегидов характерна альдегидная группа 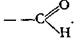
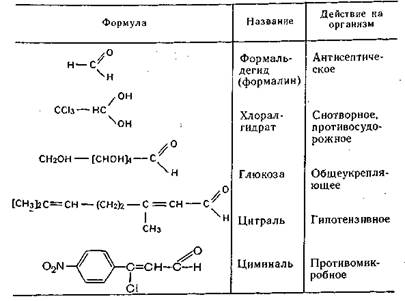
Лекарственные препараты, содержащие в молекуле альдегидную группу, и их основное действие на организм
По физическим свойствам альдегиды могут быть газообразными (формальдегид), жидкими (низшие альдегиды) и нерастворимыми твердыми (высшие альдегиды) веществами. Альдегиды хорошо растворяются в этаноле, эфире. Низшие Альдегиды имеют неприятный удушливый запах. Альдегиды с большой молекулярной массой обладают приятным цветочным запахом.
В химическом отношении альдегиды — весьма реакционноспособные соединения. Из химических свойств альдегидов, лежащих в основе реакций их идентификации, необходимо отметить следующие:
1. Альдегиды легко окисляются, являясь сами хорошими восстановителями. Восстановительная способность альдегидов выражается следующими реакциями:
а) реакция с аммиачным раствором серебра нитрата (реакция серебряного зеркала). При добавлении к аммиачному раствору нитрата серебра раствора альдегида при нагревании на стенках пробирки образуется налет восстановленного серебра в виде зеркала.
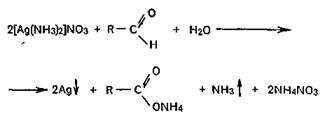
Эта реакция рекомендуется ГФ для подтверждения подлинности препаратов с альдегидной группой в молекуле;
б) реакция с реактивом Фелинга. К раствору исследуемого альдегида добавляют раствор Фелинга и нагревают, при этом постепенно выпадает осадок меди монооксида Сu2О кирпично-красного цвета;
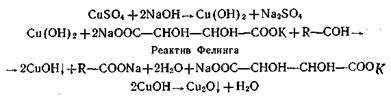
в) реакция с реактивом Несслера в щелочной среде. В результате этой реакции выпадает в осадок восстановленная ртуть темного цвета.
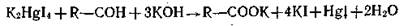
2. Реакции присоединения. Продукты присоединения альдегидов характеризуются определенной для каждого альдегида температурой плавления. Так, альдегиды легко присоединяют бисульфит натрия, образуя бисульфитные производные альдегидов — кристаллические вещества, имеющие определенную температуру плавления.
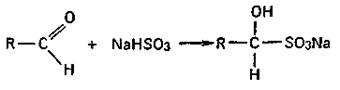
Бисульфитные производные альдегидов при нагревании с разбавленными кислотами снова распадаются на альдегид и сернистую кислоту.
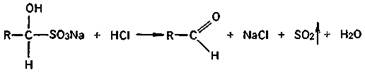
Этой реакцией пользуются не только для определения подлинности препарата с альдегидной группой в молекуле, но и для очистки альдегидов и выделения их из смесей с другими веществами, не реагирующими с бисульфитом натрия.
К реакции присоединения относится также реакция взаимодействия альдегидов с фуксинсернистой кислотой, при которой раствор окрашивается в красный или красно-фиолетовый цвет. При добавлении к реакционной смеси минеральных кислот окрашивание исчезает. Исключение составляет лишь формальдегид, в присутствии которого окраска не исчезает. Поэтому реакцию считают специфичной для формальдегида.
Фармакопейными препаратами из группы альдегидов являются: раствор формальдегида (формалин), хлоралгидрат и глюкоза.
В этой группе лекарственных препаратов мы рассматриваем также гексаметилентетрамин, физиологическое действие которого обусловлено формальдегидом, выделяющимся в кислой среде при разложении гексаметилентетрамина.
Раствор формальдегида