Основания. Химические свойства оснований.
1. Запишите основные определения и правила:
Основания –это ____________________________________________.
Щелочь – это ______________________________________________.*
Общая формула оснований: Men+(OH-)n (Ме – металл, заряд n+ металла совпадает с валентностью – обозначается римскими цифрами)
Номенклатура оснований: гидроксид металла (русское название Ме в родит. падеже) () (в скобках указывается значение заряда Ме (валентности) римскими цифрами).
ВАЖНО! не указываются римские цифры в названии у элементов с постоянной валентностью (степенью окисления, положительным зарядом): у элементов главных подгрупп из I и II групп Периодической таблицы Менделеева(совпадает с номером группы), Zn(у него всегда II или 2+) и Al(у него III или 3+), у Н. ЭТО ПРАВИЛО ДЛЯ ВСЕХ КЛАССОВ СЛОЖНЫХ ВЕЩЕСТВ!
!!! Пояснение ниже переписывать не нужно, но принять к сведению тем, у кого были проблемы в тесте по оксидам.
Чтобы при выполнении теста указать в скобках римские цифры, нужно:
переключиться на латинскую или английскую раскладку клавиатуры;
для обозначения 1 ставим латинскую заглавную букву «i» - I, 2- это два раза ставим латинскую заглавную «i»- II, а для обозначения 5 ставим латинскую заглавную «v»- V; т.е. 4 это «iv» заглавными- IV;
значение указывать в скобках без пробелов;
запомните, для каких элементов римские цифры в названии не указывают.
2. Составьте формулы гидроксидов кальция, калия, магния, хрома(III) и формулы соответствующих им оксидов.
Пример: гидроксид меди(I) Cu1+OH, ему соответствует Cu1+ 2O2- оксид меди(I).
3. Вычислить молярную массу (г/моль) для двух любых гидроксидов из задания 2.
Пример: M(Cu(OH)2)= 64+16*2+1*2=98 г/моль, можно сразу ответ без вычислений.
!!! Значения берем для каждого элемента из Периодической таблицы Менделеева, округляем значения до целых чисел по правилам математики, вычисляем сумму с учетом числа атомов каждого элемента!(§6 учебника – кто забыл)
4. Распределите на группы формулы следующих гидроксидов, используя таблицу растворимости*:
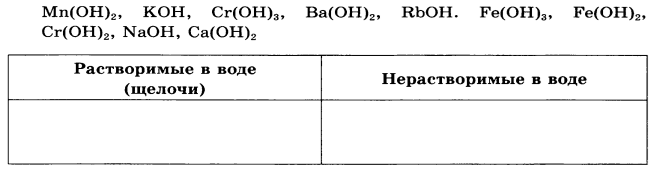
|
*К щелочам относятся растворимые и малорастворимые основания образованные литием, натрием, калием, цезием, рубидием, кальцием, стронцием, барием.
Схема: «Химические свойства оснований» (перепишите в тетрадь)
| Щ Ё Л О Ч Ь | + индикатор = изменение окраски + кислотный оксид= соль + Н2О + кислота = соль + Н2О -реакция нейтрализации + соль(растворимая) =Me(OH)n ↓+ новая соль (возможна если есть нерастворимый продукт - осадок↓) | |
| Me(OH)n↓ (нерастворимое) | t→ MexOy + Н2О + кислота = соль + Н2О -реакция нейтрализации | |
5. Внимательно изучите алгоритм 1 «Составление уравнения реакции щёлочи с кислотным оксидом» и кратко перепишите его в тетрадь.*

|
*Пункт 3 при составлении уравнения делаем на черновике или в уме, валентность кислотного остатка соответствует числу черточек (минусов) и совпадает с зарядом кислотного остатка в таблице растворимости (для оксида СО2 → кислотный остаток СО32- или =СО3, т.к. соответствующая кислотному оксиду кислота Н2СО3, угольная к-та).
Для определения формулы кислотного остатка по формуле оксида запишите в тетрадь и
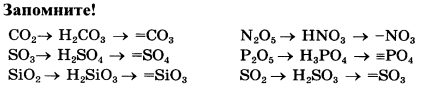
|
6. Составьте уравнения реакций по алгоритму (один столбик на выбор). Подпишите названия оксидов и солей в составленных уравнениях!
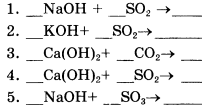
| 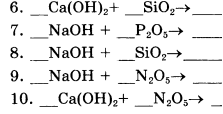
|
7. Внимательно изучите алгоритм 2 и кратко перепишите его в тетрадь.
Алгоритм 2. Составления уравнения реакции щелочи с раствором соли
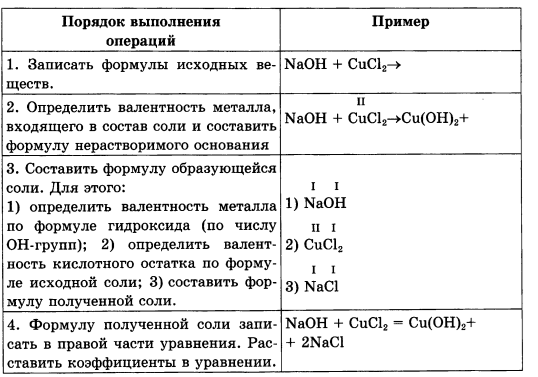
|
8.Составьте уравнения реакций по алгоритму (один столбик на выбор). Подпишите названия продуктов реакций (продукты – в-ва после стрелочки).
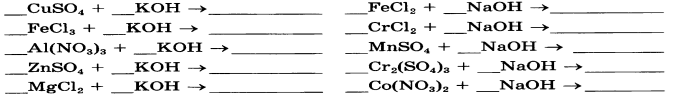
|
9. Внимательно изучите алгоритм 3 и кратко перепишите в тетрадь.
Алгоритм 3 «Составление уравнения реакции разложения нерастворимого основания»

|
Валентность металла определяется по числу гидроксогрупп в основании, значение валентности совпадает со значением заряда иона металла в таблице растворимости. Валентность и заряд иона металла в оксиде совпадает со значением валентности у металла в гидроксиде.
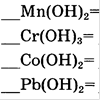
10. Составьте уравнения реакций разложения нерастворимых оснований по алгоритму (один столбик на выбор). Запишите названия образующихся оксидов. !!! Уравнивать не забывайте!
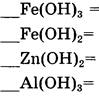
| 
|