Вышеперечисленным
Гидразин (N2H4∙H2O (Kb = 9,3 ∙ 10-7)) нельзя оттитровать раствором сильной кислоты, ПОТОМУ ЧТО, молекула гидразина не содержит в своем составе гидроксид-ионов: 1-Неверно. 2-Верно. Связь – Неверно.
Граммовое содержание серной кислоты в анализируемой пробе при прямом титровании раствором щелочи по методу отдельных навесок можно рассчитать по формуле: 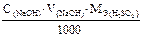
Граммовое содержание серной кислоты в анализируемой пробе при прямом титровании по методу пипетирования раствором щелочи можно рассчитать по формуле: 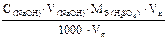
Граммовое содержание серной кислоты в анализируемой пробе при прямом титровании по методу отдельных навесок, через титр по определяемому веществу раствором щелочи можно рассчитать по формуле: 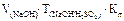
Дифениламин (С6Н5)2NH можно оттитровать раствором кислоты с индикаторным фиксированием точки эквивалентности, ПОТОМУ ЧТО дифениламин является сильным основанием (pKb = 13,21): 1-Неверно. 2-Неверно. Связь – Неверно.
Для построения кривой титрования необходимо рассчитать рН в различные моменты титрования: все ответы верны
Для построения кривой титрования слабого основания сильной кислотой рН до начала титрования рассчитывают по формуле:pН = 7 + ½ рКа + ½ lgCb
Для построения кривой титрования слабого основания сильной кислотой рН в момент полунейтрализации рассчитывают по формуле: рН = рКа + 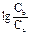
Для построения кривой титрования слабого основания сильной кислотой рН в начале
скачка титрования рассчитывают по формуле: рН = рКа + 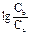
Для построения кривой титрования слабого основания сильной кислотой рН в точке эквивалентности рассчитывают по формуле: рН = ½ рKа – ½ lgСа
Для построения кривой титрования слабого основания сильной кислотой рН в конце скачка титрования рассчитывают по формуле:pН = –lg[H+]
Для построения кривой титрования слабой кислоты сильным основанием pH до начала титрования рассчитывают по формуле: рН = ½ рKа – ½ lgСа
Для построения кривой титрования слабой кислоты сильным основанием pH от начала титрования до точки эквивалентности рассчитывают по формуле : = рКа + 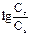
Для построения кривой титрования слабой кислоты сильным основанием pH в начале скачка титрования рассчитывают по формуле: рН = рКа + 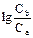
Для построения кривой титрования слабой кислоты сильным основанием pH в точке эквивалентности рассчитывают по формуле: pН = 7 + ½ рКа + ½ lgCb
Для построения кривой титрования слабой кислоты сильным основанием pH в конце скачка титрования рассчитывают по формуле: рН = 14 – рОН
Для проведения анализа титриметрическим методом необходимо наличие: Всего выше перечисленного.
Для стандартизации растворов щелочей в качестве первичных стандартов используют щавелевую кислоту, бензойную, сульфаминовую и др., ПОТОМУ ЧТО эти кислоты отвечают требованиям для первичных стандартов и реагируют со щелочами быстро, стехиометрически, с резким изменением рН вблизи эквивалентности: 1-Верно. 2-Верно. Связь – Верно.
Используя метод алкалиметрии по способу обратного титрования, можно определить содержание: Сложных эфиров карбоновых кислот.; Солей аммония, хлоралгидрата и др.
Используя метод ацидиметрии, способом прямого титрования, можно определить содержание: Сильных и слабых оснований (Kb ≥10-7); Алифатических аминов (Kb ≥10-7).*
К реакциям в титриметрических методах анализа предъявляются следующие требования: Достаточная скорость реакции.;Стехиометрические соотношения компонентов.;Возможность фиксирования точки эквивалентности.
Как титруется в присутствии индикаторов винная кислота, H2C4H4O6 (Kа1 = 1,3 ∙ 10-3, Kа2 = 3,0 ∙ 10-5): Как двухосновная к-та.
Как титруется в присутствии индикаторов гликолевая кислота, HO–CH2–COOH (Kа = 1,5 ∙ 10-4): Как одноосновная к-та.
Как титруется в присутствии индикаторов глутаминовая кислота HOOC–(CH2)2–CH(NH2)–COOH (Kа1 = 4,7 ∙ 10-5, Kа2 = 8,7 ∙ 10-11): Как одноосновная к-та.
Как титруется в присутствии индикаторов глутаровая кислота HOOC(CH2)3COOH (Kа1 = 4,6 ∙ 10-5, Kа2 = 5,4 ∙ 10-6): Как двухосновная кислота.
Как титруется в присутствии индикаторов малеиновая кислота HOOC–CH=CH–COOH (Kа1 = 1,2 ∙ 10-2, Kа2 = 6,0 ∙ 10-7): И то, и другое
Как титруется в присутствии индикаторов малоновая кислота HOOCCH2COOH (Kа1 = 4,2 ∙ 10-2, Kа2 = 2,1 ∙ 10-6): И то, и другое.
Как титруется в присутствии индикаторов мышьяковистая кислота H3AsO3 (Kа1 = 5,9 ∙ 10-10): Ни то, ни другое.
Как титруется в присутствии индикаторов ортоборная кислота H3BO3 (Kа1 = 7,1 ∙ 10-10, Kа2 = 1,8 ∙ 10-13, Kа3 = 1,6 ∙ 10-14): Ни то, ни другое.
Как титруется в присутствии индикаторов угольная кислота H2CO3 (Kа1 = 4,5 ∙ 10-7, Kа2 = 4,8 ∙ 10-11): Как одноосновная кислота.
Как титруется в присутствии индикаторов щавелевая кислота H2C2O4 (Kа1 = 5,6 ∙ 10-2, Kа2 = 5,4 ∙ 10-5): Как двухосновная кислота.
Какие индикаторы применяют в случаях титрования раствора CH3COOH раствором NaOH: Фенолфталеин.
Какие индикаторы применяют в случаях титрования раствора Na2B4O7 раствором HCl: Метиловый оранжевый.
Какие индикаторы применяют в случаях титрования раствора Na2CO3 раствором HCl: И то, и другое.
Какие индикаторы применяют в случаях титрования раствора NaOH раствором HCl: И то, и другое.
Какие индикаторы применяют в случаях титрования раствора NH3 раствором HCl: Метиловый оранжевый.
Какие растворы можно стандартизовать с помощью первичного стандар-та калия гидрофталата в водных растворах: И то, и другое.
Какие растворы можно стандартизовать с помощью первичного стандарта натрия тетрабората в водных растворах: Раствор кислоты.
Какие растворы можно стандартизовать с помощью первичного стандарта щавелевой кислоты в водных растворах: Раствор щелочи.
Какие растворы можно стандартизовать с помощью первичного стандарта янтарной кислоты в водных растворах: Раствор щелочи.
Какие растворы можно стандартизовать с помощью первичного стандарта натрия сульфата в водных растворах: Ни то, ни другое.
Какими методами кислотно-основного титрования можно определить содержание в растворе серной кислоты: Алкалиметрия
Какими методами кислотно-основного титрования можно определить содержание в растворе натрия гидрокарбоната: Ацидиметрия
Какими методами кислотно-основного титрования можно определить содержание в растворе натрия гидрофосфата: Ацидиметрия
Какими методами кислотно-основного титрования можно определить содержание в растворе калия сульфат: Ни то, ни другое
Какими методами кислотно-основного титрования можно определить содержание в растворе калия гидрофталата: И то, и другое
Какой из приведенных ниже законов является теоретической основой титриметрических методов анализа: Закон эквивалентов.
Конец скачка титрования – это: Вещество перетировано на 0,1%.
Конечную точку титрования в методе кислотно-основного титрования определяют при помощи рН-индикаторов. При подборе рН индикаторов учитывают: рН среды в точке эквивалентности.
Константа титрования - это: все ответы верны
Кривая титрования – это: Графическое изображение изменения рH в процессе титрования
Массовую долю (в %) серной кислоты в анализируемой пробе при прямом титровании по методу пипетирования раствором щелочи можно рассчитать по формуле : 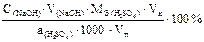
Массовую долю (в %) серной кислоты в анализируемой пробе при прямом титровании по методу отдельных навесок раствором щелочи можно рассчитать по формуле: 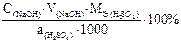
Метод кислотно-основного титрования применяют для определения: все ответы верны
Муравьиную кислоту (Ka = 1,8 ∙ 10-4) и уксусную кислоту (Ka = 1,7 ∙ 10-5) нельзя оттитровать в смеси раздельно, ПОТОМУ ЧТО муравьиная и уксусная кислоты имеют близкие значения констант кислотности: 1-Верно. 2-Верно. Связь – Верно.
На основании каких данных, судят о количестве определяемого вещества в титриметрических методах анализа: Объемов титранта и исследуемого раствора, вступивших в реакцию
Наряду с кислотно-основным титрованием в водных средах в практике анализа часто используют титрование в неводных средах. Подберите подходящие растворители для количественного определения пиридина (Kb = 1,5 ∙ 10-9): Протогенные растворители (ледяная уксусная кислота, муравьиная кислота, уксусный ангидрид и др.).
Наряду с кислотно-основным титрованием в водных средах в практике анализа часто используют титрование в неводных средах. Подберите подходящие растворители для количественного определения смеси слабых кислот: Дифференцирующие растворители (кетоны, нитрилы).
Наряду с кислотно-основным титрованием в водных средах в практике анализа часто используют титрование в неводных средах. Подберите подходящие растворители для количественного определения очень слабых кислот (Kа<5 ∙ 10-7): Протофильные растворители (ДМФА, формамид, пиридин, этиленди-амин).
Наряду с кислотно-основным титрованием в водных средах в практике анализа часто используют титрование в неводных средах. Подберите подходящие растворители для количественного определения азотсодержащих оснований (Kb = 5 ∙ 10-7): Протогенные растворители (ледяная уксусная кислота, муравьиная кислота, уксусный ангидрид и др.).
Наряду с кислотно-основным титрованием в водных средах в практике анализа часто используют титрование в неводных средах. Подберите подходящие растворители для количественного определения бензойной кислоты (Kа = 6,3 ∙ 10-5): Амфипротные (нейтральные) растворители (метанол, этанол).
Натрия карбонат и натрия гидрокарбонат в смеси нельзя определить раздельно, ПОТОМУ ЧТО при титровании смеси натрия карбоната и натрия гидрокарбоната кислотой, из натрия карбоната образуется натрия гидрокарбонат: 1-Неверно. 2-Верно. Связь – Неверно.
Начало скачка титрования – это: Недотитровано 0,1% вещества.
Один из способов количественного подбора рН индикаторов – подсчет индикаторных ошибок, обусловленных несоответствием рН в точке конца титрования (рТ индикатора) рН в точке эквивалентности. Подберите название ошибки и формулу для расчета за счет недотитрования сильных кислот или перетирования слабых оснований: Протонная ошибка: 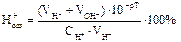
Один из способов количественного подбора рН индикаторов – подсчет индикаторных ошибок, обусловленных несоответствием точки конца титрования (рН индикатора) точке эквивалентности. Подберите название ошибки и формулу для расчета за счет недотитрования щелочей и перетитрования слабых кислот: Гидроксидная ошибка: 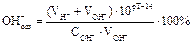
Один из способов количественного подбора рН индикаторов – подсчет индикаторных ошибок, обусловленных несоответствием точки конца титрования (рН индикатора) точке эквивалентности. Подберите название ошибки и формулу для расчета за счет недотитрования слабых кислот: Кислотная ошибка: 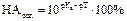
Один из способов количественного подбора рН индикаторов – подсчет индикаторных ошибок, обусловленных несоответствием точки конца титрования (рН индикатора) точке эквивалентности. Подберите название ошибки и формулу для расчета за счет недотитрования слабого основания: Основная (щелочная) ошибка: 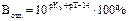
Один из способов количественного подбора рН индикаторов – подсчет индикаторных ошибок, обусловленных несоответствием точки конца титрования (рН индикатора) точке эквивалентности. Подберите название ошибки и формулу для расчета сдвига точки конца титрования при увеличении концентрации индикатора: Концентрационная индикаторная ошибка: 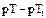
Определение азота по Кьельдалю включает следующие стадии: Все перечмсленные.
Основные характеристики рН-индикаторов являются: Интервал перехода.
Первичные стандарты должны отвечать требованиям: Всем
Первичными стандартами называются вещества: Обладающие всеми перечисленными свойствами.
По методу кислотно-основного титрования можно определять все кислоты и основания, ПОТОМУ ЧТО, все кислоты взаимодействуют со щелочами, а все основания взаимодействуют с кислотами: 1-Неверно. 2-Верно. Связь – Неверно.
По методу кислотно-основного титрования можно определять все соли, ПОТОМУ ЧТО катионы и анионы всех солей представляют собой либо кислоты, сопряженные с основанием, либо основания, сопряженные с кислотами: 1-Неверно. 2-Верно. Связь – Неверно.
По методу кислотно-основного титрования при визуальном фиксиро-вании точки эквивалентности можно определять (в водных растворах): Сильные кислоты.;Сильные основания
По методу кислотно-основного титрования прямым титрованием можно определять: Вещества с кислотно-основными свойствами, если Ka(b)≥ 5 ∙ 10-7.
Подберите метод кислотно-основного титрования при определении калия гидрофталата: И то, и другое.
Подберите метод кислотно-основного титрования при определении карболовой кислоты (Ка = 1 ∙ 10-10): Ни то, ни другое.
Подберите метод кислотно-основного титрования при определении натрия карбоната: Ацидиметрия
Подберите метод кислотно-основного титрования при определении натрия гидрокарбоната: Ацидиметрия
Подберите метод кислотно-основного титрования при определении серной кислоты: Алкалиметрия.
Подберите определение понятия «интервал перехода индикатора»: Значения рН, при которых происходит видимое изменение окраски индикатора.
Подберите определение понятия «конечная точка титрования»: Момент окончания титрования.
Подберите определение понятия «показатель титрования индикатора»: Значение рН, при котором заканчивают титрование с данным индикатором.
Подберите определение понятия «точка нейтральности»: Момент при титровании, когда рН = 7.
Подберите определение понятия «точка эквивалентности»: Количество титранта строго эквивалентное количеству определяемого вещества.
Подберите первичный стандарт для стандартизации примерно 0,05 М раствора серной кислоты: Натрия карбонат.
Подберите первичный стандарт для стандартизации примерно 0,05 М раствора бария гидроксида: Щавелевая кислота.
Подберите первичный стандарт для стандартизации примерно 0,1 М раствора калия гидроксида: Щавелевая кислота.
Подберите первичный стандарт для стандартизации примерно 0,1 М раствора хлороводородной кислоты: Натрия карбонат.
Подберите первичный стандарт для стандартизации примерно 0,1 М раствора азотной кислоты: Натрия карбонат.
Подберите первичный стандарт для стандартизации раствора азотной кислоты: Дифенилгуанидин.
Подберите первичный стандарт для стандартизации раствора бария гидроксида: Бензойная кислота.
Подберите первичный стандарт для стандартизации раствора калия гидроксида: Бензойная кислота.
Подберите первичный стандарт для стандартизации раствора натрия гидроксида: Бензойная кислота.
Подберите первичный стандарт для стандартизации раствора серной кислоты: Дифенилгуанидин.
Подберите подходящие методические приемы с учетом указанных ниже условий определения, если анализируемого вещества достаточно: Метод пипетирования
Подберите подходящие методические приемы с учетом указанных ниже условий определения, если анализируемого вещества мало: Метод отдельных навесок
Подберите подходящие методические приемы с учетом указанных ниже условий определения, если требуется высокая точность определения: Метод отдельных навесок
Подберите подходящие методические приемы с учетом указанных ниже условий определения, если анализ надо провести быстро :Метод пипетирования
Подберите подходящие методические приемы с учетом указанных ниже условий определения, если исследуемый раствор окрашен: Фиксирование точки эквивалентности инструментальными метода-ми
Подберите подходящий методический прием, если вещество непосред-ственно не взаимодействует с тирантом: Титрование по замещению.
Подберите подходящий методический прием, если вещество реагирует с титрантом стехиометрически с достаточной скоростью: Способ прямого титрования.
Подберите подходящий методический прием, если вещество реагирует с титрантом стехиометрически, но медленно: Способ обратного титрования
Подберите подходящий методический прием, если вещество реагирует с титрантом стехиометрически и быстро, но нельзя подобрать индикатор: Титрование с инструментальным фиксированием точки эквивалент-ности.
Подберите подходящий методический прием, если вещество реагирует с титрантом быстро, но не стехиометрически: Титрование по замещению.
Подберите подходящую формулу для расчета массы анализируемого вещества, прямое титрование, метод пипетрования: 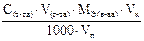
Подберите подходящую формулу для расчета массы анализируемого вещества, прямое титрование, метод отдельных навесок: 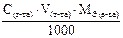
Подберите подходящую формулу для расчета массы анализируемого вещества, обратное титрование, метод отдельных навесок: 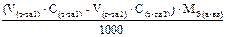
Подберите подходящую формулу для расчета навески анализируемого вещества при титровании по методу отдельных навесок: 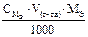 (Vт = 10 – 20 мл)
(Vт = 10 – 20 мл)
Подберите подходящую формулу для расчета навески анализируемого вещества при титровании по методу пипетирования: 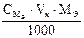
Подберите соответствующий характер кривой титрования при титрова-нии слабой кислоты сильным основанием: рН при титровании меняется плавно.
Подберите соответствующий характер кривой титрования при титрова-нии сильного основания сильной кислотой: рН при титровании меняется резко.
Подберите соответствующий характер кривой титрования при титрова-нии слабого основания сильной кислотой: рН при титровании меняется плавно.
Подберите соответствующий характер кривой титрования при титрова-нии слабой кислоты слабым основанием: Скачок на кривой титрования отсутствует.
Подберите соответствующий характер кривой титрования при титро-вании сильной кислоты сильным основанием: рН при титровании меняется резко.
Подберите формулу для расчета граммового содержания анализируемого вещества способом прямого титрования, методом отдельных навесок: 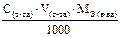
Подберите формулу для расчета граммового содержания анализируемого вещества способом прямого титрования, методом отдельных навесок, через титр по определяемому веществу: 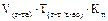
Подберите формулу для расчета массовой доли (в %) анализируемого вещества способом обратного титрования, методом отдельных навесок: 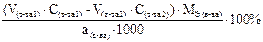
Подберите формулу для расчета массовой доли (в %) анализируемого вещества способом прямого титрования, методом отдельных навесок: 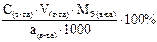
Подберите формулу для расчета массовой доли (в %) анализируемого вещества способом обратного титрования, методом пипетирования: 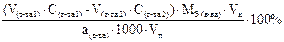
Подберите формулу для расчета массовой доли (в %) анализируемого вещества с учетом прямого способа титрования и метода отдельных навесок: 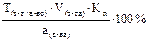
Подберите формулу для расчета массовой доли (в %) анализируемого вещества с учетом
прямого способа титрования и метода пипетирования: 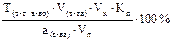
Подберите формулу для расчета массовой доли (в %) анализируемого вещества с учетом обратного способа титрования и метода отдельных навесок: 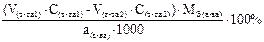
Подберите формулу для расчета массовой доли (в %) анализируемого вещества с учетом обратного способа титрования и метода пипетирования: 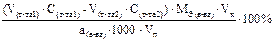
Подберите формулу для расчета массовой доли (в %) анализируемого вещества с учетом заместительного титрования и метода отдельных навесок: 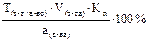
Подберите формулу для расчета молярной концентрации эквивалента титранта: 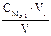
Подберите формулу для расчета навески раствора: 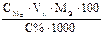
Подберите формулу для расчета навески твердого вещества: 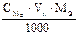
Подберите формулу для расчета поправочного коэффициента к молярной концентрации эквивалента: 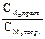
Подберите формулу для расчета титра раствора: 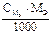
Подберите формулы для расчета молярной концентрации эквивалента концентрации по титру: 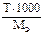
Подберите формулы для расчета молярной концентрации эквивалента по навеске: 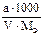
Подберите формулы для расчета навески твердого вещества: 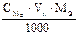
Подберите формулы для расчета титра по навеске: 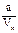
Подберите формулы для расчета титра по определяемому веществу : 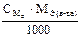
При подборе рН-индикаторов наиболее существенное значение имеет: рН среды в точке эквивалентности.
При титровании веществ по способу прямого титрования результат анализа можно рассчитать по формулам: все ответы верны
Применение рН-индикаторов в виде смешанных индикаторов делает перемену окраски индикаторов в конце титрования более резкой, ПОТОМУ ЧТО окраска рН-индикатора на фоне индифферентного красителя фиксируется нашим глазом более четко: 1-Верно. 2-Верно. Связь – Верно.
Пропионовую кислоту и уксусную кислоту можно оттитровать в растворе дифференцированно, ПОТОМУ ЧТО пропионовая кислота и уксусная кислота имеют близкие значения показателей кислотности (для пропионовой кислоты pKa = 4,87, для уксусной кислоты pKa = 4,76): 1-Неверно. 2-Верно. Связь – Неверно.
Раствор может содержать хлороводородную кислоту, фосфорную кислоту или натрия дигидрофосфат (один компонент или два в разумном сочетании). На титрования 25,00 мл этого раствора израсходовано 0,1 М раствора натрия гидроксида до: перехода окраски метилоранжа – 18,72 мл и перехода окраски фенолфталеина – 23,60 мл. Используйте эту информацию для установления состава раствора и подберите подходящий ответ: Раствор содержит хлороводородную кислоту и фосфорную кислоту.
Раствор может содержать хлороводородную кислоту, фосфорную кислоту или натрия дигидрофосфат (один компонент или два в разумном сочетании). На титрования 25,00 мл этого раствора израсходовано 0,1 М раствора натрия гидроксида до: перехода окраски метилоранжа – 7,93 мл и перехода окраски фенолфталеина – 7,95 мл. Используйте эту информацию для установления состава раствора и подберите подходящий ответ: Раствор содержит хлороводородную кислоту
Раствор может содержать хлороводородную кислоту, фосфорную кислоту или натрия дигидрофосфат (один компонент или два в разумном сочетании). На титрования 25,00 мл этого раствора израсходовано 0,1 М раствора натрия гидроксида до: перехода окраски метилоранжа – 0,00 мл и перехода окраски фенолфталеина – 16,77 мл. Используйте эту информацию для установления состава раствора и подберите подходящий ответ: Раствор содержит натрия дигидрофосфат.
Раствор может содержать хлороводородную кислоту, фосфорную кислоту или натрия дигидрофосфат (один компонент или два в разумном сочетании). На титрования 25,00 мл этого раствора израсходовано 0,1 М раствора натрия гидроксида до: перехода окраски метилоранжа – 13,12 мл и перехода окраски фенолфталеина – 35,19 мл. Используйте эту информацию для установления состава раствора и подберите подходящий ответ: Раствор содержит фосфорную кислоту и натрия дигидрофосфат
Раствор может содержать хлороводородную кислоту, фосфорную кислоту или натрия дигидрофосфат (один компонент или два в разумном сочетании). На титрования 25,00 мл этого раствора израсходовано 0,1 М раствора натрия гидроксида до: перехода окраски метилоранжа – 13,33 мл и перехода окраски фенолфталеина – 26,65 мл. Используйте эту информацию для установления состава раствора и подберите подходящий ответ: Раствор содержит фосфорную кислоту.
Растворы, в которых находится одно из веществ: натрия гидроксид, натрия гидрокарбонат, натрия карбонат, или одна из смесей: натрия карбонат и натрия гидроксид, натрия карбонат и натрия гидрокарбонат – титруют раствором хлороводородной кислоты последовательно с фенолфталеином V1(HCl) = 10,00 мл и метилоранжем V2(HCl) = 20,00 мл. На основании результатов титрования каждого из растворов, укажите, какое вещество или какая смесь содержится в растворе: Натрия карбонат.
Растворы, в которых находится одно из веществ: натрия гидроксид, натрия гидрокарбонат, натрия карбонат, или одна из смесей: натрия карбонат и натрия гидроксид, натрия карбонат и натрия гидрокарбонат – титруют раствором хлороводородной кислоты последовательно с фенолфталеином V1(HCI) = 7,50 мл и метилоранжем V2(HCl) = 25,00 мл. На основании результатов титрования каждого из растворов, укажите, какое вещество или какая смесь содержится в растворе: Натрия карбонат и натрия гидрокарбонат.
Растворы, в которых находится одно из веществ: натрия гидроксид, натрия гидрокарбонат, натрия карбонат, или одна из смесей: натрия карбонат и натрия гидроксид, натрия карбонат и натрия гидрокарбонат – титруют раствором хлороводородной кислоты последовательно с фенолфталеином V1(HCI) = 18,00 мл и метилоранжем V2(HCI) = 26,00 мл. На основании результатов титрования каждого из растворов, укажите, какое вещество или какая смесь содержится в растворе: Натрия гидроксид и натрия карбонат.
Растворы, в которых находится одно из веществ: натрия гидроксид, натрия гидрокарбонат, натрия карбонат, или одна из смесей: натрия карбонат и натрия гидроксид, натрия карбонат и натрия гидрокарбонат – титруют раствором хлороводородной кислоты последовательно с фенолфталеином V1(HCI) = 00,00 мл и метилоранжем V2(HCI) = 16,00 мл. На основании результатов титрования каждого из растворов, укажите, какое вещество или какая смесь содержится в растворе: Натрия гидрокарбонат.
Растворы, в которых находится одно из веществ: натрия гидроксид, натрия гидрокарбонат, натрия карбонат, или одна из смесей: натрия карбонат и натрия гидроксид, натрия карбонат и натрия гидрокарбонат – титруют раствором хлороводородной кислоты последовательно с фенолфталеином V1(HCI) = 20,00 мл и метилоранжем V2(HCI) = 20,00 мл. На основании результатов титрования каждого из растворов, укажите, какое вещество или какая смесь содержится в растворе: Натрия гидроксид.
Расчет рН раствора сильного основания, производят по формуле: pН = 14 – pОН
Расчет рН раствора сильной кислоты, производят по формуле: pН = –lg[H+]
Расчет рН раствора слабого основания, производят по формуле: pН = 7 + ½ рКа + ½ lgCb
Расчет рН раствора слабой кислоты, производят по формуле: рН = ½ рKа – ½ lgСа
Расчет рН раствора, содержащего слабую кислоту и соль этой кислоты, производят по
формуле: рН = рКа + 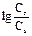
Реакции, применяемые в титриметрических методах анализа, должны отвечать требованиям: все ответы верны
Ртути(II) амидохлорид определяют ацидиметрически по способу обратного титрования, ПОТОМУ ЧТО при растворении ртути(II) амидохлорида в избытке 0,1 н. раствора HCl в присутствии KI, часть хлороводородной кислоты вступает в реакцию, а остаток не прореагировавшей HCI оттитровывают раствором щелочи: 1-Верно. 2-Верно. Связь – Верно.
С какими индикаторами можно титровать натрия гидрокарбонат: Метиловый оранжевый.
С какими индикаторами можно титровать натрия дигидрофосфат: Фенолфталеин.
С какими индикаторами можно титровать натрия карбонат: И то, и другое
С какими индикаторами можно титровать натрия оксалат: Ни то, ни другое.
С какими индикаторами можно титровать ортофосфорную кислоту: И то, и другое
Салициловую кислоту C6H4(OH)COOH (Ka1= 1,1 ∙ 103 , Ка2 = 2,6 ∙ 10-14) можно оттитровать и как одноосновную, и как двухосновную, ПОТОМУ ЧТО салициловая кислота диссоциирует ступенчато; по I степени – как одноосновная кислота, по II – как двухосновная кислота: 1-Неверно. 2-Верно. Связь – Неверно.
Скачок титрования – это: Резкое изменение pH вблизи точки эквивалентности
Слабые кислоты с константой кислотности больше или равной 5 ∙ 10-7 можно оттитровать раствором щелочи с визуальным фиксированием точки эквивалентности, ПОТОМУ ЧТО на кривой титрования кислот с константой кислотности равной или больше 5 ∙ 10-7 скачок еще позволяет подобрать индикатор: 1-Верно. 2-Верно. Связь – Верно.
Слабые кислоты с константой кислотности равной или больше 5 ∙ 10-7 нельзя оттитровать раствором щелочи, ПОТОМУ ЧТО на кривой титрования кислот с константой кислотности равной или больше 5 ∙ 10-7 скачок титрования значительно уже, чем при титровании сильных кислот: 1-Неверно. 2-Верно. Связь – Неверно.
Содержание натрия карбоната и натрия гидрокарбоната в смеси при прямом титровании хлороводородной кислотой с двумя индикаторами – фенолфталеином и метилоранжем – можно рассчитать по формулам: все ответы верны
Содержание солей аммония можно определять: Способом обратного титрования (по избытку).;Способом замещения.;Формольным титрованием.
Титрантами (стандартными растворами, рабочими растворами) называют растворы реагентов: C известной концентрацией, используемые при титровании.
Титрованные растворы сильных кислот готовят по способу установлен-ного титра, ПОТОМУ ЧТО сильные кислоты не отвечают требованиям для первичных стандартов: 1-Верно. 2-Верно. Связь – Верно.
Титрованный раствор хлоровордородной кислоты готовят по способу установленного титра, ПОТОМУ ЧТО хлороводородная кислота не отвечает требованиям для первичных стандартов: 1-Верно. 2-Верно. Связь – Верно.
Точка эквивалентности – это: Добавлено строго эквивалентное количество титранта.
Укажите вещество, при титровании которого 0,1 М раствором хлорово-дородной кислоты наблюдается самый большой скачок титрования: Натрия гидроксида.
Укажите методы титрования: Пипетрование и отдельных навесок.
Укажите основной способ выражения концентрации титрантов: Молярная концентрация эквивалента.
Укажите способы подбора рН-индикаторов: Качественный и количественный.
Укажите способы приготовления титрованных растворов: Приготовленного и установленного титра.
Укажите способы титрования: Прямые и косвенные.
Укажите способы фиксирования точки конца титрования: Индикаторные и инструментальные.
Укажите характер кривой титрования при титровании раствора борной кислоты, H3BO3 (Kа1 = 7,1 ∙ 10-10, Kа2 = 1,8 ∙ 10-13, Kа3 = 1,6 ∙ 10-14) 0,1 М раствором щелочи: Скачок на кривой титрования отсутствует.
Укажите характер кривой титрования при титровании раствора дихлор-уксусной кислоты, (Сl2CHCOOH, Kа = 5 ∙ 10-2) 0,1 М раствором щелочи: Скачок на кривой титрования большой.
Укажите характер кривой титрования при титровании раствора малеиновой кислоты, HООC–CH=CH–COOH (Kа1 = 1,2 ∙ 10-2, Kа2 = 6,0 ∙ 10-7) 0,1 М раствором щелочи: На кривой титрования четко выражены два скачка.
Укажите характер кривой титрования при титровании раствора сернис-той кислоты, H2SO3 (Kа1 = 1,4 ∙ 10-2, Kа2 = 6,2 ∙ 10-8) 0,1 М раствором щелочи: На кри