КОМИ ФИЛИАЛ
Государственного бюджетного образовательного учреждения высшего профессионального образования «КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
Министерства здравоохранения и социального развития Российской Федерации
Кафедра химии, физики, биологии
Методические указания для студентов 1 курса
Специальности (направления подготовки) 060101 – Лечебное дело
к практическому (лабораторному) занятию
по дисциплине Химия
ТЕМА: Зачетное занятие
ЦЕЛЬ: Проверить знания студентов по изученным темам дисциплины.
ЗАДАЧИ:
1. Проанализировать знания путем тестирования.
2. Закрепить знания по дисциплине путем разбора расчетных и ситуационных задач.
СОДЕРЖАНИЕ ЗАНЯТИЯ:
Вводный контроль.
Тестирование по теме занятия. Примерный перечень тестовых заданий:
1. Раствором является
1) мел 2) спирт 3) родниковая вода 4) кислород
2. Раствором является
1) бронза 2) железо 3) медь 4) цинк
3. Раствором является
1) кислород 2) водород 3) воздух 4) аммиак
4. Жиры хорошо растворяются в
1) воде 2) хлороформе 3) соляной кислоте 4) физиологическом растворе
5. Жиры не растворяются в
1) эфире 2) хлороформе 3) воде 4) толуоле
6. К электролитам относится
1) пергидроль 2) этиловый спирт
3)физиологический раствор 4) иодная тинктура
7. К электролитам относится
1) этиловый спирт 2) глюкоза 3) хлористый кальций 4) глицерин
8. К неэлектролитам относится
1) сахароза * 2) серная кислота 3) хлороводород 4) хлористый натрий
9. Растворителем в крови является
1) белки 2) вода 3) соли 4) углеводы
10. Растворителем в моче является
1) белки 2) вода 3) соли 4) углеводы
11. Веществом, нерастворимым в воде, является
1) спирт 2) сода 3) нашатырный спирт 4) эфир диэтиловый
12. Единицы измерения титра раствора
1) моль/л 2) моль/мл 3) г/мл 4) г/моль
13. Единицы измерения молярной концентрации
1) моль/л 2) моль/кг 3) г/мл 4) г/моль
14. Единицы измерения молярной концентрации эквивалента
1) г/л 2) % 3) моль/л 4) г/моль
15. Титр иодной тинктуры, в 200 мл которого содержится 10 г кристаллического иода, равняется (г/мл)
1) 0,05 2) 0,16 3) 0,2 4) 0,4
16. Титр соляной кислоты в желудочном соке с молярной концентрацией 0,1 моль/л равняется
1) 0,056 2) 0,00365 3) 0,0024 4) 0,0071
17. Масса пероксида водорода, содержащаяся в 50 г 3%-ного раствора
1) 0,2 г Н2О2 2) 0,5 г Н2О2 3) 1,5 г Н2О2 4) 20 г Н2О2
18. Процентная концентрация раствора, полученного смешением 50 мл этилового спирта (пл. 0,8 г/мл) и 60 г воды
1) 20% 2) 40% 3) 30% 4) 50%
19. Молярная масса эквивалента серной кислоты в реакции
H2SO4 + Cu(OH)2 -> CuSO4 + 2H2O
1) 9,8 г /моль 2) 49 г/моль 3) 98 г/моль 4) 196 г/моль
20. Молярная масса эквивалента серной кислоты в реакции H2SO4+NaOH→NaHSO4+H2O
1) 9,8 г/моль 2) 49 г/моль 3) 98 г/моль 4) 196 г/моль
21. Молярная масса эквивалента соляной кислоты
1) 17 г/моль 2) 35,5 г/моль 3) 36,5 г/моль 4) 40 г/моль
22. Концентрация ионов водорода в крови при рН 7,4
1) 10-7,4 2) 7,4 3) 0,74 4) -7,4
23. Концентрация ионов водорода в желудочном соке при рН = 1
1) 0,01 2) 0,1 3) 1 4) 10
24. рН желудочного сока при концентрации соляной кислоты в нем 0,1 моль/л равен
1) 0,1 2) 1 3) 2 4)13
24. К коллигативньгм свойствам относится
1) атмосферное давление 2) осмотическое давление
3) температура замерзания растворов 4) температура кипения растворов
25. К коллигативным свойствам относится
1) температура замерзания растворов
2) понижение температуры замерзания растворов
3) концентрация раствора
4) плотность раствора
26. К коллигативным свойствам не относится
1) температура 2) осмотическое давление
3) понижение температуры замерзания растворов
4) повышение температуры кипения растворов
27. Осмотическое давление для разбавленного раствора неэлектролита определяется по формуле
1) Росм = iCT 2) Росм = CRT
3) Росм = 2RT 4) Росм = КС
28.Осмотическое давление крови человека прли 310 К (37аС) равно
1) 1,5 атм 2) 5 атм 3) 7,7 атм 4) 10 атм
29. Растворы, осмотическое давление которых тмпны между собой, называются
1) изотоническими 2) гипертоническими
3) гипотоническими 4) насыщенными
30. Физиологическим раствором является
1) 10% раствор NaCl 2) 0,9% раствор NaCl
3) 0,1% раствор NaCl 4) 0,9% раствор НС1
31. Осмотическое давление физиологического раствора (0,15 моль/л) при 37°С равно (i=1,2)
1) 463,7 кПа 2) 320,5 кПа 3) 850,6 кПа 4)156,3 кПа
32.Вещество, растворимость в воде которого уменьшается при повышении температуры
1) кислород 2) поваренная соль 3) сода 4) этиловый спирт
33.Вещество, растворимость в воде которого увеличивается при повышении температуры
1) кислород 2) поваренная соль 3) углекислый газ 4)аммиак
34. Состав фосфатного буфера в эритроцитах человека
1) NaH2PO4 + Na2HPO4
2) Na3PO4 + H3PO4
3) KH2PO4 + K2HPO4
4) K3PO4 + H3PO4
35. Пары веществ, образующие аммиачную буферную систему
1) хлорид аммония и гидроксид аммония
2) ацетат натрия и уксусная кислота
3) хлорид аммония и соляная кислота
4) гидроксид аммония и гидроксид калия
36. Пары веществ, образующие гидрокарбонатную буферную систему
1) карбонат натрия и угольная кислота
2) ацетат натрия и угольная кислота
3) гидрокарбонат натрия и угольная кислота
4) карбонат натрия и гидрокарбонат натрия
37. Пары веществ, образующие ацетатную буферную систему
1) ацетат натрия и угольная кислота
2) ацетат натрия и угольная кислота
3) гидрокарбонат натрия и уксусная кислота
4) карбонат натрия и уксусная кислота
38. Пары веществ, образующие лактатную буферную систему
1) лактат натрия и молочная кислота
2) пируват натрия и молочная кислота
3) лактат натрия и пировиноградная кислота
4) пируват натрия и пировиноградная кислота
39. Пары веществ, не являющиеся буферной системой
1) Na2CO3 и NaHCO3 2) NaHCO3 и H2CO3
3) HCl и H2CO3 4) Na H2PO4 и Na2HPO4
40. Пары веществ, не являющиеся буферной системой
1) NaOH и NH4OH 2) Na2HPO4 и NaH2PO4
3) NaHCO3 и H2CO3 4) CH3COONa и CH3COOH
41. В плазме крови максимальную буферную емкость имеет
1) фосфатный буфер 2) аммиачный буфер
3) гидрокарбонатный буфер 4) гемоглобиновый буфер
42. Ион NH4+ пo теории Бренстеда-Лоури
1) кислотой 2) основанием 3) амфолитом
4) не проявляет кислотно-основных свойств
43. Ион СО32- по теории Вренстеда-Лоури является
1) кислотой 2) основанием 3) амфолитом
4) не проявляет кислотно-основных свойств
44. Ион H2 PO4- по теории Бренстеда-Лоури является
1) кислотой 2) основанием 3) амфолитом
4) не проявляет кислотно-основных свойств
45. Интервал рН действия ацетатного буфера
1) 1,76-2,76 2) 3,76-5,76 3) 6,76-8,76 4) 7,76-10,7
46. Интервал рН действия фосфатного буфера в организме
1) 3,76-5,76 2) 4,76-6,26 3) 5,86-7,86 4) 9,26-11,26
47. Интервал рН действия аммиачного буфера
1) 1,76-3,7 2) 3,76-5,26 3) 4,86-6,86 4) 8,24-10,24
48. Реакция, протекающая при добавлении кислоты к гидрокарбонатному буферу
1) H2CO3 + OH- → HCO3- + H2O 2) H+ + HCO3- → H2CO3
3) CO3 2- + H+ → HCO3- 4) HCO3- + OH- → CO32- + H2O
49. Реакция, протекающая при добавлении щелочи к гидрокарбонатному буферу
1) H2CO3 + OH- → HCO3- + H2O 2) H+ + HCO3- → H2CO3
3) CO3 2- + H+ → HCO3- 4) HCO3- + OH- → CO32- + H2O
50. Реакция, протекающая при добавлении кислоты к фосфатному буферу
1) H2РO4- + OH- → HРO42- + H2O 2) H+ + РO43- → НРO4 2-
3) НРO4 2- + H+ → H2РO4- 4) H2РO4- + H+ → Н3РO4
51. Реакция, протекающая при добавлении щелочи к фосфатному буферу
1) H2РO4- + OH- → HРO42- + H2O 2) H+ + РO43- → НРO4 2-
3) НРO4 2- + H+ → H2РO4- 4) H2РO4- + H+ → Н3РO4
52. Реакция, протекающая при добавлении кислоты к аммиачному буферу
1) NH4 Cl + OH- → NH4OH+ Cl- 2) H+ + OH- → Н2O
3) NH3 ∙ Н2O + H+ → NH4OH+ OH- 4) NH4OH + H+ → NH4 -+ Н2O
53. Реакция, протекающая при добавлении щелочи к аммиачному буферу
1) NH4 Cl + OH- → NH4OH+ Cl- 2) H+ + OH- → Н2O
3) NH3 ∙ Н2O + H+ → NH4OH+ OH- 4) NH4OH + H+ → NH4 -+ Н2O
54. Самая быстро реагирующая буферная система крови
1) бикарбонатная 2) фосфатная 3) белковая 4) гемоглобинная
55. Самая мощная буферная система крови (75% всей буферной емкости)
1) бикарбонатная 2) фосфатная 3) белковая 4) гемоглобиновая
56. рН крови в норме
1) 7,27-7,34 2) 7,37-7,44 3) 7,47-7,54 4) 7,57-7,64
57. рН крови при ацидозе
1) <7.36 2)=7,36 3) =7,4 4)>8
58. рН крови при алкалозе
1) <7.36 2) =7,36 3) =7,4 4) >8
59. рН мочи при смешанной диете в норме
1) 3,2-4,5 2) 4,5-5,0 3) 5,5-6,5 4) 7,0-7,5
60. рН мочи при смешанной диете в норме
1) сильнокислая 2) слабокислая 3) нейтральная 4) слабощелочная
61. Уравнение для расчета рН аммиачного буфера
1)  2)
2) 
3)  4)
4) 
62. Уравнение Гендерсона-Гассельбаха для расчета рН буферных систем 1 типа
1)  2)
2) 
3)  4)
4) 
63. Уравнение для расчета рН фосфатной буферной системы




64. Уравнение для расчета буферной емкости по щелочи
1)  2)
2) 
3)  4)
4) 
65. Значение рН аммиачного буфера (рКb = 4,76), в котором отношение концентраций компонентов равно единице
1) 4,76 2) 7,0 3) 9,24 4) 10,26
66.рН ацетатного буфера, содержащего по 0,1 моль/л уксусной кислоты (рКa = 4,76) и ацетата натрия
1) 4,26 2) 4,76 3) 7,0 4) 9,26
67. рН фосфатного буфера, содержащего по 0,1 моль/л обоих компонентов (рКа = 6,86)
1) 5,86 2) 4,76 3) 6,86 4) 7,36
68. Условие, при котором протекают изотермические процессы
1) Т = const 2) V = const 3) p = const 4) S = const
69. Условие, при котором протекают изобарные процессы
1) Т = const 2) S = const 3) V = const 4) p = const
70. Условие, при котором протекают изохорные процессы
1) T = const 2) S = const 3) V = const 4) p = const
71. Термодинамические системы, обменивающиеся со средой как веществом, так и энергией, называются
1) закрытыми 2) изолированными 3) открытыми 4) гомогенными
72. Открытые термодинамические системы могут обмениваться с окружающей средой
1) только веществом 2) веществом и энергией
3) нет обмена с окружающей средой 4) только энергией
73. Закрытые термодинамические системы могут обмениваться с окружающей средой
1) только веществом 2) веществом и энергией
3) нет обмена с окружающей средой 4) только энергией
74. Изолированные термодинамические системы могут обмениваться с окружающей средой
1) только веществом 2) веществом и энергией
3) нет обмена с окружающей средой 4) только энергией
75. Закрытой термодинамической системой является
1) термос с водой 2) грелка с водой
3) пробирка с водой 4) тарелка с водой
76. Изолированной термодинамической системой является
1) баллон с газом 2) грелка с водой
3) стакан со льдом 4) термос с водой
77. Функцией состояния термодинамической системы является
1) температура 2) энтальпия 3) давление 4) объем
78. Функцией состояния термодинамической системы является
1) концентрация 2) температура 3) теплоемкость 4) внутренняя энергия
79. Функцией состояния, характеризующей степень неупорядоченности системы, является
1) энергия Гиббса 2) энтальпия 3) энтропия 4) внутренняя энергия
80. Фазовый переход, в котором энтропия увеличивается
1) газ → жидкость 2) твердое тело → жидкость
3) газ → твердое тело 4) жидкость→твердое тело
81. Процесс, в котором энтропия увеличивается
1) возгонка йода 2) конденсация пара
3) затвердевание бетона 4) образование росы
82. Процесс, в котором энтропия уменьшается
1) выпаривание воды 2) горение дров
3) разведение спирта водой 4) образование росы
83. Энтропия уменьшается в реакции
1) 2CH4(г) → C2H2(г) + 3H2(г) 2) 2SO2(г) + O2 (г) → 2SO3(г)
3) C2H8(г) + 5O2 (г) → 3CO2 (г) +4Н2О (г) 4) 2Na + 2H2O → 2NaOH +H2
84. Энтропия увеличивается в реакции
1) 2C2 H10(г) → 2C2H6(г) + 2С2H4(г) 2) Cm(г) + 2H2 (г) → CO4(г)
3) H2(г) + I2 (г) → 2HI(г) 4) 2H2 + O2(г) → 2H2O(г)
85. Процессы, в которых происходит увеличение энтальпии (∆Н>0)
1) эндотермические 2) изотермические
3) экзотермические 4) изотонические
86. Процессы, в которых происходит уменьшение энтальпии (∆Н<0)
1) эндотермические 2) изохорные 3) экзотермические 4) изобарные
87. Вещество, имеющее стандартную энтальпию образования, равную нулю (∆Н°обр.=0)
1) Н2О 2) О2 3) H2SO4 4) H2Te
88. Тепловой эффект реакции (∆ H0хр) C6H12O6 +6O2 → 6CO2 +6H2O вычисляется по уравнению
1) ∆Н°хр= ∆Н°обр.(СО2) + ∆Н°обр.(Н2О) -∆Н°обр. (С2Н12О6)
2) ∆Н°хр= ∆Н°обр.(С2Н12О6) -6 ∆Н°обр.(СО2) -6∆Н°обр. (Н2О)
3) ∆Н°хр= 6∆Н°обр.(СО2) + 6∆Н°обр.(Н2О) -∆Н°обр. (С2Н12О6)
4) ∆Н°хр= ∆Н°обр.(С2Н12О6) - ∆Н°обр.(СО2) -∆Н°обр. (Н2О)
89. Условие, характеризующее экзэргонические реакции
1) ∆Н >0 2) ∆G < 0 3) ∆Н <0 4) ∆G > 0
90. Условие, характеризующее эндэргонические реакции
1) ∆Н > 0 2) ∆G < 0 3) ∆Н < 0 4) ∆G > 0
91. Условие, при котором возможно самопроизвольное протекание реакции
1) ∆Н >0 2) ∆G < 0 3) ∆Н <0 4) ∆G > 0
92. Процесс, являющийся экзэргоническим
1) фосфорилирование глюкозы 2) ацилирование глицерина
3) окисление глюкозы 4) образование гликогена
93. Изменение энергии Гиббса химических реакций протекающих в изобарно- изотермических условиях, рассчитывается по формуле
1) ∆G 0=∆Н0-Т∆S0 2) ∆G 0=∆Н0+Т∆S0 3) ∆G 0=∆S0-Т ∆Н0 4) ∆G 0=∆S0+Т ∆Н0
94. Величина ∆G0 при условии Кравн.=1 равна
1) ∆G0 = 0 2) ∆G0< 0 3) ∆G0 > 0 4) ∆G0 = 1
95. Константа равновесия при условии ∆G0 =0 равна
1) Кравн.= 0 2) Кравн.= 1 3) Кравн.= 2 4) Кравн.= 3
96. Равновесие реакции N2+3H2 →2NH3 + Q смещается
1) вправо при нагревании 2) влево при нагревании
3) вправо при понижении давления 4) влево при повышении давления
97. Условие, вызывающее смещение равновесия 2SO2 +O2 → 2SO3 + Q в сторону прямой реакции (вправо)
1) понижение давления 2) нагревание
3) увеличение концентрации SO3 4) повышение давления
98. Условие, вызывающее смещение равновесия 2SO2 +O2 → 2SO3 + Q в сторону обратной реакции (влево)
1) увеличение концентрации О2 2) нагревание
3) увеличение концентрации SO2 4) повышение давления
99. Условие, выбывающее смещение равновесия CO2 +C(т) →2СО- Q в сторону прямой реакции (вправо)
1) увеличение концентрации углерода 2) охлаждение
3) понижение концентрации СО2 4) понижение давления
100.Условие, вызывающее смещение равновесия CO2 +C(т) →2СО- Q в сторону обратной реакции (влево)
1) увеличение концентрации углерода 2) нагревание
3) повышение концентрации СО2 4) повышение давления
101. Условие, выбывающее смещение равновесия
FeCl3 +3KCNS → Fe(CNS)3 +3KCl в сторону прямой реакции (вправо)
1) увеличение концентрации KCNS 2) уменьшение концентрации FeCl3
3) увеличение концентрации KCl 4) повышение давления
102. Мономолекулярной реакцией является
1) 2SO2 + O2 → 2SO2 2) H2 + Br2 →2HBr
3) 2HI → H2 + I2 4) MgCO3 → MgO + CO2
103. Бимолекулярной реакцией является
1) 2NO + O2 → 2NO 3) CaCO3 → CaO + CO2
2) SO2 + CI2 → SO2 4) N2 + 3H2 → 2NH3
104. Тримолекулярной реакцией является
1) C2H4 + H2 → C2H6 3) CO + 2H2 → 2NH3
2) C + H2O → CO + H2 4) F2 + H2 → 2HF
105. Реакция H2 + I2 → 2HI является
1) мономолекулярной 3) тримолекулярной
2) бимолекулярной 4) первого порядка
106. Реакция C4H10 → C2H6 + C2H4 является
1) мономолекулярной 3) тримолекулярной
2) бимолекулярной 4) первого порядка
107. Реакция гидролиза крахмала
крахмал →декстраны →мальтоза →глюкоза является
1) сопряженной 3) параллельной
2) цепной 4) последовательной
108. Реакция образования оксигемоглобина Hb + O2 → HbO2 имеет общий порядок, равный
1) 0 2) 0,5 3) 1 4) 2
109. Типы сложных реакций, к которым относится пероксидное окисление липидов
1) сопряженные 3) параллельные
2) цепные 4) последовательные
110. Типы сложных реакций в организме с участием АТФ
1) сопряженные 3) параллельные
2) цепные 4) последовательные
111. Фотохимической реакцией является
1) синтез АТФ 3) аэробное окисление глюкозы
2) образование озона 4) гидролиз АТФ
112. Общая схема ферментативного анализа
1) S + E → P → E 3) S + E → SE → E + P
2) S → PS → P + S 4) P + E → PE → E + S
113. Кинетическим уравнением бимолекулярной реакции является
1) υ = ķ · С1 · С2 2) υ = ķ · С1² · С2
3) υ = ķ · С1 · С2² 4) υ =  · С1 · С2
· С1 · С2
114. Кинетическим уравнением мономолекулярной реакции является
1) υ = ķ · С1 · С2 2) υ = ķ · С
3) υ = ķ · С1 · С2² 4) υ = ķ
115. Уравнение Аррениуса
1)  2) k1 = k2 · γ
2) k1 = k2 · γ 
 3)
3) 
 4) k = A · e
4) k = A · e 

116. Уравнение Вант – Гоффа
1)  2)
2) 
 3) k1 = k2 · γ
3) k1 = k2 · γ 
 4) k = A · e
4) k = A · e 

117. Уравнения Михаэлиса–Ментен показывает зависимость скорости ферментативной реакции от
1) давления 3) концентрации
2) температуры 4) присутствия катализаторов
118. Уравнение Михаэлиса–Ментен
1) υ max =  2) υcm =
2) υcm = 
 3) υcm =
3) υcm = 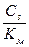 4) υ max = =
4) υ max = = 
119. При увеличении концентрации реагента в 3 раза скорость реакции I порядка
1) уменьшается в 3 раза 3) увеличивается в 3 раза
2) увеличивается в 9 раз 4) уменьшается в 9 раз
120. При увеличении концентрации реагентов в 2 раза скорость реакции II порядка
1) увеличивается в 2 раза 3) уменьшается в 4 раза
2) увеличивается в 4 раза 4) уменьшается в 2 раза
121. Уравнение Вант-Гоффа показывает зависимость скорости реакции от
1) давления 3) концентрации
2) температуры 4) размеров реагирующих веществ
122. Температурный коэффициент в уравнении Вант – Гоффа может меняться в
1) 1 – 2 раза 2) 2 – 4 раза 3) 2 – 6 раз 4) 2 – 8 раз
123. При повышении температуры на 30оС скорость реакции с температурным коэффициентом γ=2
1) увеличится в 5,48 раз 3) увеличится в 8 раз
2) увеличится в 6 раз 4) уменьшится в 15 раз
124. При понижении температуры на 20оС скорость реакции с температурным коэффициентом γ=3
1) увеличится в 6 раз 3) уменьшится в 3 раза
2) увеличится в 9 раз 4) уменьшится в 9 раз
125. Температурный коэффициент показывает, во сколько раз возрастает скорость реакции при повышении температуры
1) на 10оС 2) в 10 раз 3) на 1оС 4) в 2 раза
126. Растворимым веществом является
1) карбонат кальция СаСО3 3) сульфит бария ВаSO3
2) бромид серебра АgBr 4) фосфат натрия Na3PO4
127. Нерастворимым веществом является
1) карбонат калия K2C3 3) сульфат натрия Na2SO4
2) йодид серебра AgJ 4) гидрофосфат натрия Na2HPO4
128. Система, в которой образуется осадок
1) нитрат калия + хлорид бария 2) бромид рубидия + карбонат натрия
3) сульфат калия + йодид бария 4) фосфат натрия + хлорид аммония
129. Система, в которой образуется осадок
1) гидроксид калия + хлорид бария 2) бромид рубидия + нитрат серебра
3) сульфат аммония + йодид натрия 4) гидросульфид калия + хлорид натрия
130. Вещество, меньше всех растворяющееся в воде
1) сульфат кальция CaSO4 KПР (CaSO4) = 2,0 · 10-5
2) фторид кальция CaF2 KПР (CaF2) = 4,01 · 10-11
3) фосфат кальция Сa3(PO4)2 KПР (Сa3(PO4)2) = 2,0 · 10-29
4) карбонат кальция CaCO3 KПР (СаСО3) = 3,8 · 10-9
131. Состав основного неорганического вещества зубной эмали
1) Ca10(РО4)6СО3 3) Са10(РО4)6(ОН)2
2) Са10(РО4)6F2 4) Са3РО4)2
132. Состав основного неорганического вещества костной ткани
1) Ca10(РО4)6СО3 3) Са10(РО4)6(ОН)2
2) Са10(РО4)6F2 4) Са3РО4)2
133. Сульфат кальция CaSO4 лучше всего растворяется в
1) речной воде 3) дистиллированной воде
2) морской воде 4) водопроводной воде
134. Антидотное действие сульфата магния MgSO4 по отношению к образованию камней проявляется в том, что
1) сульфат магния растворяет оксалатные камни
2) сульфат магния растворяет уратные камни
3) соосаждается вместе с оксалат-ионами и выводится из организма
4) соосаждается вместе с уратными камнями и выводится из организма
135. Оксалатные камни в качестве основного вещества содержат
1) ураты калия и натрия 2) карбонаты магния и кальция
3) оксалаты кальция 4) сульфаты кальция и бария
136. Желчные камни в качестве основного вещества содержат
1) сульфат бария 2) оксалаты и ураты кальция
3) карбонаты магния и кальция 4) желчные кислоты и их соли
137. Выражением для расчета константы растворимости фосфата кальция Са3(РО4)2 является
1) Кs = [Cа2+] [ 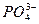 ] 2) Кs = [Ca2+] 3 [
] 2) Кs = [Ca2+] 3 [ 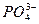 ]
]
3) Ks = [Cа2+]3 [ 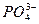 ]2 4) Кs = [Ca2+] [
]2 4) Кs = [Ca2+] [ 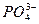 ]2
]2
138. Выражение для расчета константы растворимости сульфида алюминия Al2S3 является
1) Кs = [Al3+] [S2-] 2) Кs = [Al3+]3[S2-]2
3) Кs = [Al3+]2[S2-] 4) Кs = [Al3+]2[S2-]3
139. Выражением для расчета константы растворимости карбоната цинка ZnCO3 является
1) Кs = [Zn2+][CO  ] 2) Кs = [Zn2+][CO
] 2) Кs = [Zn2+][CO  ]3
]3
3) Кs = [Zn2+]2[CO  ] 4) Кs = [Zn2+]3[CO
] 4) Кs = [Zn2+]3[CO  ]2
]2
140. Единицей измерения растворимости является
1) моль / г 2) г / моль 3) моль / л 4) г / мл
141. Уравнением для расчета растворимости является
1) S =  2) S =
2) S =  3) S =
3) S =  4) S =
4) S = 
142. Осадок, образующийся при взаимодействии нитрата серебра AgNO3 c хроматом калия К2СгO4
1) хромат серебра 2) металлический хром
3) нитрат калия 4) металлическое серебро
143. Осадок, образующийся при взаимодействии перманганата калия КМnO4 с сульфитом калия K2SO3 в нейтральной среде
1) сера свободная 2) оксид марганца
3) сульфит марганца 4) сульфид марганца
144. Условия образования осадка сульфата свинца PbSO4
1) C2(Pb2+)  2(SO
2(SO  ) > Ks(PbSO4) 2) C2(Pb2+)
) > Ks(PbSO4) 2) C2(Pb2+)  2(SO
2(SO  ) < Ks(PbSO4)
) < Ks(PbSO4)
3) C2(Pb2+)  (SO
(SO  ) > Ks(PbSO4) 4) C(Pb2+)
) > Ks(PbSO4) 4) C(Pb2+)  (SO
(SO  ) > Ks(PbSO4)
) > Ks(PbSO4)
145. Условия образования осадка фосфата серебра Ag3PO4
1)  2)
2) 
3)  4)
4) 
146. Условия образования осадка сульфата бария BaSO4
1)  2)
2) 
3)  4)
4) 
147. Формула расчета растворимости фосфата серебра Ag3PO4
1) S =  2) S =
2) S =  3) S =
3) S =  4) S =
4) S = 
148. Формула расчета растворимости сульфата свинца PbSO4
1) 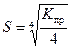 2)
2) 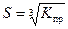 3)
3) 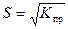 4)
4) 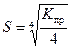
149. Растворимость фосфата серебра Ag3PO4 (Ks(Ag3PO4) = 1,3  -20) в насыщенном растворе равна
-20) в насыщенном растворе равна
1) 5 • 10-8 моль/л 2) 1,25 • 10-3 моль/л
3) 1,07 • 10-5 моль/л 4) 5 • 10-10 моль/л
150. Растворимость сульфата бария BaSO4 (Ks (BaSO4) = 10-10) в насыщенном растворе равна
1) 1 • 10-5 моль/л 3) 2 • 10-5 моль/л
2) 1,25 • 10-6 моль/л 4) 5 • 10-11 моль/л
151. Координационная формула соли состава Fe(CN)2 • 4KCN (желтая кровяная соль)
1)К4[Fe(CN)6] 2) К2[Fe(CN)6] 2) K3[Fe(CN)6] 4) K3[Fe(CN)3]
152. Координационная формула соли состава Fe(CN)2 • 3KCN (красная кровяная соль)
1) К4[Fe(CN)6] 2) К2[Fe(CN)6] 3) K3[Fe(CN)6] 4) K3[Fe(CN)3]
153. Координационная формула соли состава Co(CNS)3 ∙ 3KCNS
1) K3[Co(CNS)6] 2) K2[Co(CNS)6] 3) K4[Co(CNS)6] 4) K2[Co(CNS)4]
154. Координационное число комплексообразователя равно
1) степени окисления комплексообразователя
2) числу монодентатных лигандов
3) числу бидентатных лигандов
4) половине степени окисления комплексообразователя
155. Дентатность лиганда равна
1) координационному числу комплексообразователя
2) степени окисления комплексообразователя
3) числу координационных мест, занимаемых данным лигандом
4) удвоенной степени окисления комплексообразователя
156. Координационное число иона кобальта в соединении К3[Co(CNS)6] равно
1) 6 2) 3 3) 4 4) 2
157. Координационнаяформула соли состава CoCl3 ∙ 5NH3
1) [Co(NH3)5]Cl3 2) [Co(NH3)5Cl2]Cl
3) [Co(NH3)5Cl3] 4) [Co(NH3)5Cl]Cl2
158. Координационное число иона кобальта в соединении [Co(NH3)5Cl]Cl2 равно
1) 3 2) 5 3) 4 4) 6
159. Название соединения [Co(NH3)5NO2]Br2
1) бромонитропентаамминкобальта (III)
2) бромид пентаамминнитрокобальта (III)
3) пентаамминнитробромид кобальта (III)
4) пентаамминнитрозобромид кобальта (III)
160. Название соединения K4[Co(CNS)6]
1) гексароданокобальтат (II) калия 2) гексацианокобальтат (II) калия
3) гексароданокобальтат (IV) калия 4) гексароданокобальтат (III) калия
161. Название соединения [Pt(NH3)2Cl2]
1) хлорид диамминоплатины (II) 2) хлородиамминоплатины (II)
3) дихлородиамминоплатины (II) 4) дихлорид диамминоплатины (II)
162. Координационная формула соединения хлорида хлоропентаамминокобальта (III)
1) [Co(NH3)5Cl]Cl2 2) [Co(NH3)5]Cl3
3) [Co(NH3)5Cl2]Cl 4) [Co(NH3)5Cl3]
163. Координационная формула соединения дибромодихлородиаквакобальтата (III) калия
1) K2[Co(H2O)2Br2Cl2] 2) K[Co(H2O)2Br2Cl2]
3) K3[Co(H2O)2Br2Cl2] 4) K[Co(H2O)4Br2Cl2]
164. Координационная формула соединения дибромодийодомеркурата (II) аммония
1) (NH4)2[HgBr2I2] 2) (NH4)2[HgBr2I]
3) (NH4)2[HgBrI2] 4) (NH4)[HgBr2I2]
165. Координационная формула комплексного соединения общей формулой CoCl3•5NH3, при действии на которое нитратом серебра осаждается 2/3 cодержащегося в нем хлора
1) [Co(NH3)5Cl]Cl2 2) [Co(NH3)5]Cl3
3) [Co(NH3)5Cl2]Cl 4) [Co(NH3)5Cl3]
166. Координационная формула комплексного соединения общей формулой 2KCl•PtCl4, при действии на которое нитратом серебра осадок не образуется, и в растворе не обнаружены ионы платины
1) K[PtCl6] 2) K4[PtCl6]
3) K3[PtCl6] 4) K2[PtCl6]
167. Название соединения

1) нитрилотриуксусная кислота
2) пропилендиаминтетрауксусная кислота
3) этилендиаминтетрауксусная кислота
4) нитрилотрифосфоновая кислота
168. Наиболее прочным комплексным ионом является
1) [Cu(NH3)4]2+ 2) [Ag(NH3)2]+ 3) [Zn(NH3)4]2+ 4) [Ni(NH3)4]2+
169. Наиболее прочное комплексное соединение ион Cu2+ образует
1) с аммиаком 2) с водой 3) с хлорид-ионом 4) с трилоном Б
170. Наименее прочное комплексное соединение ион Cu2+ образует
1) с аммиаком 2) с водой 3) с хлорид-ионом 4) с трилоном Б
171. Константа нестойкости комплексного иона [Ag(NH3)2]+ рассчитывается по формуле

172. Константа нестойкости комплексного иона [Fe(CN)6]3- рассчитывается по формуле

173. Концентрация ионов кобальта Co3+ в 0,1 моль/л растворе [Co(NH3)6]Cl3 (Kнест=6,17•10-36) равна
1) 4,68 • 10-7 моль/л 2) 1,446 • 10-6 моль/л
3) 6,2 • 10-3 моль/л 4) 5,62 • 10-8 моль/л
174. Концентрация ионов кадмия Cd2+ в 0,01 моль/л растворе K2[Cd(CN)4] (Kнест=1,4•10-19) равна
1) 2,23 • 10-5 моль/л 2) 9,44 • 10-6 моль/л
3) 3,24 • 10-3 моль/л 4) 1,62 • 10-4 моль/л
175. Ион, входящий в состав гема
1) Fe2+ 2) Co3+ 3) Mo2+ 4) Mn2+
176. Количество гем–групп в макромолекуле гемоглобина
1) 1 2) 4 3) 2 4) 6
177. Количество связей иона Fe2+ c порфириновым циклом при образовании гема
1) 2 2) 5 2) 4 4) 6
178. Ион Fe2+ гемоглобина наиболее прочную связь образует с
1) кислородом 2) угарным газом
3) углекислым газом 4) водой
179. Связь, образующаяся между ионом железа и кислородом при оксигенации
1) металлическая 2) водородная
3) координационная 4) ионная
180. Ион, входящий в состав цианкобаламина
1) Fe3+ 2) Co3+ 2) Mo2+ 4) Mn2+
181. Терапевтическим действием при онкологических заболеваниях обладает
1) транс - дихлородиамминоплатина (II)
2) цис - дихлородиамминоплатина (II)
3) тетрахлороплатинат (II) калия
4) цис - трихлороамминоплатина (II)
182. Соединением, применяющимся в хелатотерапии, является
1) ДДТ 2) ЭДТФ 3) ЭДТА 4) НТФ
183. Способность растворенного вещества изменять поверхностное натяжение раствора называется
1) поверхностной активностью 2) поверхностной энергией
3) поверхностным натяжением 4) поверхностной силой
184. Вещества, понижающие поверхностное натяжение, называются
1) поверхностно - активные (ПАВ) 2) поверхностно - неактивные (ПНВ)
3) поверхностно - инактивные (ПИВ) 4) поверхностно - реактивные (ПРВ)
185. Вещества, незначительно повышающие поверхностное натяжение, называются
1) поверхностно - неактивные (ПНВ) 2) поверхностно - активные (ПАВ)
3) поверхностно - реактивные (ПРВ) 4) поверхностно - инактивные (ПИВ)
186. Вещества, раствор которого имеет наименьшее поверхностное натяжение
1) пропионовая кислота 2) уксусная кислота
3) масляная кислота 4) муравьиная кислота
187. Вещества, раствор которого имеет наибольшее поверхностное натяжение
1) этанол 2) бутанол 3) пентанол 4) гексанол
188. К поверхностно-активным веществам относится
1) С8Н18 2) С17Н35СООNa 3) H2SO4 4) NaOH
189. К поверхностно-активным веществам относится
1) мыло 2) бензин 3) поваренная соль 4) питьевая сода
190. Поверхностно-активным веществом не является
1) желчные кислоты
2) соляная кислота из желудочного сока
3) дипальмитоиллецитин из легочного сурфактанта
4) белок слюны
191. Изотерма поверхностного натяжения показывает зависимость поверхностного натяжения от
1) объема 2) давления 3) концентрации 4) температуры
192. Кислота, обладающая наибольшей полярностью
1) HCOOH 2) C2H5COOH 3) CH3COOH 4) C3H7COOH
193. Кислота, обладающая наименьшей полярностью
1) валериановая 2) масляная 3) уксусная 4) капроновая
194. Вещество, обладающее наименьшей полярностью
1) гексанол 2) бутанол 3) пентанол 4) холестерол
195. Неполярным адсорбентом является
1) уголь 2) силикагель 3) глина 4) речной песок
196. Полярным адсор