Природа сил химической связи – электрическая.
Квантовая механика позволяет объяснить и описать
Образование всех типов химических связей.
 | |||
 |




| молекула | связь | Е св, кДж/моль | l св, нм | вывод |
| F2 | F – F | 159,0 | 0,142 | Чем меньше l св, тем больше Е св и устойчивее молекула |
| H2 | H – H | 436,0 | 0,074 | |
| О2 | О = О | 498,7 | 0,120 | Чем выше кратность* связи, тем больше Е св и устойчивее молекула |
| N2 | N º N | 945,6 | 0,109 |


 |
| |||
 |
Существует два основных квантово-механических приближенных методов описания ковалентной связи: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
 | |||||
| |||||
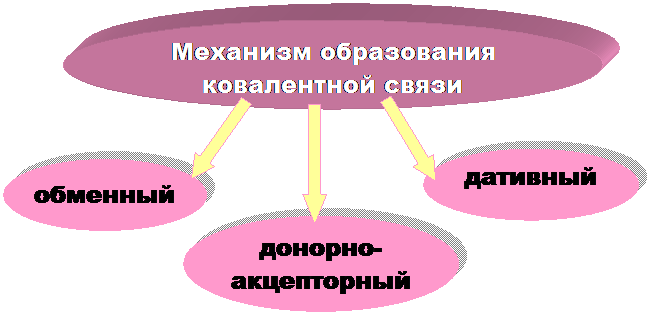 |
► Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному электрону.
► Донорно-акцепторный механизм - образование общей электронной пары за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
ПРИМЕР: образование иона аммония NН4+ (NН3 + Н+ ® NН4+)

►Дативные связи – образуются, когда АО одного атома, могут выступать одновременно в роли и донора и акцептора неподеленных пар электронов.
 |
ПРИМЕР: образование молекулы Cl2
Следствие - энергия связи в молекуле Сl2 (243 кДж/моль) выше, чем в молекуле F2 (159 кДж/моль), несмотря на большую длину связи.
 | |||||
 | |||||
 |
s - связь – связь, образуемая по линии, соединяющей центры атомов;
p - связь – связь, при которой перекрывание облаков происходит над и под воображаемой линией, соединяющей центры атомов;
δ – связь – связь, образуемая при наложении друг на друга и перекрывании d-облаков в 4-х областях
Перекрывание АО разных типов при образовании
s - связей:
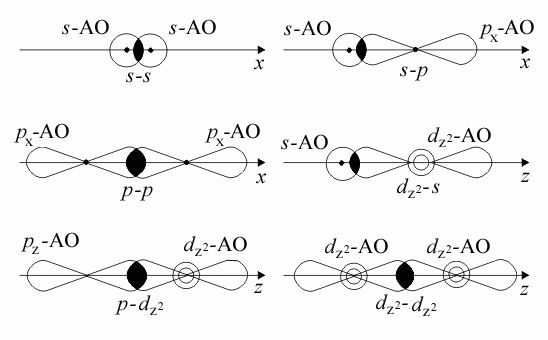
Образование тройной связи в молекуле азота N2:
одна s- связь и две p - связи.
Кратность связи равна трем:

Направления перекрывания атомных орбиталей
при образовании d -связей:



Молекула НI:
1 s -АО атома водорода Н перекрываются с 5 p – АО атома иода I, имеющими по одному неспаренному электрону:
 | |||
| |||
|
Механизм образования связи - обменный. Тип связи - s-связь.
Кратность связи - 1, структура молекулы – линейная.
Связь – полярная, так как образована атомами с разной ЭО
ЭО(I) = 2,5 ЭО(H) = 2,1
Þ связывающая электронная пара смещена в сторону I: Þ эффективный отрицательный заряд ( δ -) у атома I,
эффективный положительный заряд ( δ +) у атома Н
Þ возникает электрический диполь.
|
д л и н а диполя l Д:
 |
электрический момент диполя связи m св
(количественная мера полярности связи):
|
m св некоторых связей:
 |
| молекула | DЭО | m св×10-30,Кл×м | Вывод |
| Н – Сl | 0,90 | 1,03 | Чем больше DЭО, тем больше m св и, следовательно, связь более полярная |
| Н – Br | 0,74 | 0,78 | |
| H - I | 0,40 | 0,38 |
m св ~ 0 - 10 Д (1 Дебай = 3,33.10-30 Кл.м.)

