В многоатомных молекулах имеется несколько связей, возникает электрический момент диполя молекулы.
|
Электрический момент
диполя молекулы (m м) Þ
Полярность молекулы зависит от ее геометрической структуры. Молекула неполярна, если m м = S m св =0,
молекула полярна, если m м = S m св ¹0.
примеры:
8 Образование молекулы Н2S:
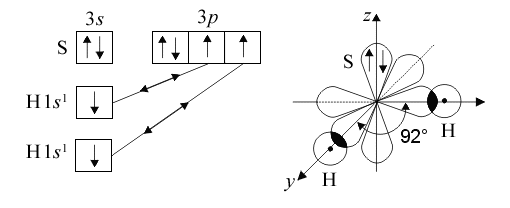
Þ угловая структура (Ð920)
ЭО(Н) = 2,1 и ЭО(S) = 2,5 Þ связь полярная, m св ¹ 0
Структура молекулы Н2S – угловая, и векторная сумма дипольных моментов связи m св имеет вид:
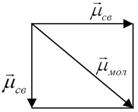
m м = S m св ¹ 0 Þ молекула в целом полярная.
8Образование молекулы SbH3 :
 Sb…5 s 25 p 3
Sb…5 s 25 p 3
H1s H1s H1s
|

Гибридизация атомных орбиталей –
|
Если у атома в образовании химических связей участвуют разные по типу АО (s-, p-, d- или f- АО), то химические связи образуются с участием не «чистых», а «смешанных», или гибридных орбиталей.
Форма гибридной орбитали:

 Схема sр -гибридизации
Схема sр -гибридизации  Схема sр2-гибридизации
Схема sр2-гибридизации
 Схема sр3-гибридизации
Схема sр3-гибридизации
| Орбитали, участвующие в гибридизации | Тип гибридизации | Структура молекулы | Валентный угол |
| S + p | sp |  Линейная
Линейная
| 180о |
| S + p + p | sp2 |  плоский треугольник
плоский треугольник
| 120о |
| S + p + p + p | sp3 |  тетраэдр
тетраэдр
| 109,3о |
Рассмотрим примеры:
8Молекула ВеСl2

■ sp -гибридизация АО Ве, 2 s - связи, Ð180о
■ пространственная структура Þ линейная.

Cl Be Cl
■ ЭОCl =3,0, ЭОBe = 1,5 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0
Þ Cl Be ® Cl
■ m мол = S m св = 0 Þ молекула в целом неполярная.
8Молекула ВН3
 |
В… 2s22p1 Þ В* …2s12p2 H …1s1
H 1s1 H 1s1 H 1s1

■ sp2–гибридизация АО бора В
■ 3 s - связи, Ð 120°,
■ ЭОB =2,0, ЭОH = 2,1 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0
■ структура молекулы - плоский треугольник.
■ m мол = S m св = 0 Þ молекула ВН3 - неполярная.
8Молекула SnCl4
Sn …5s25p2 Þ Sn* …5s15p3 Cl … 3s23p5
Sn* …5s15p  3
3
Cl 3s23p5 Cl 3s23p5 Cl 3s23p5
■ sp3–гибридизация АО Sn (s -АО и 3 р- АО)
■ структура молекулы Þ тетраэдр, 4 s - связи
Ð 109,30
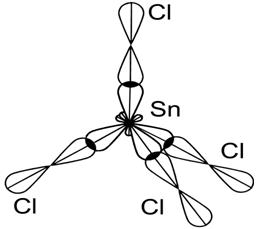
■ ЭОCl =3,0, ЭОSn = 1,8 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0.
■ m мол = S m св = 0 Þ молекула SnCl4 - неполярная.

Молекулы NН3 и Н2О
 N…2s22p3 O…2s22p4
N…2s22p3 O…2s22p4
 |
H 1s1 H 1s1 H 1s1 Н 1s1 Н 1s1
Структура молекул – тетраэдр. Метод ВС не объясняет структуру молекул, определенную методом рентгеноструктурного анализа
sp 3 – гибридизация АО азота N и кислорода О.
● В гибридизации могут участвовать вакантные АО, АО с неподеленными парами электронов и АО с неспаренными электронами.
● Неподеленные электронные пары (НП) влияют на величину валентных углов Þ силы отталкивания между ними больше, чем между относительно закрепленными электронными парами образующими связь (связывающая электронная пара - СП).
● Уменьшение силы отталкивания электронных пар:
НП-НП > НП-СП > СП-СП
В молекуле NН3 одна НП уменьшает тетраэдрический угол (109,3о) до 107о, а в молекуле Н2О две НП уменьшают его до 104,5о.
Пространственная структура молекул:
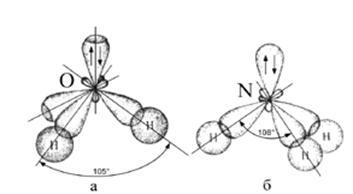
Н2О NН3
 | |||
|
Ионная связь не обладает:
▼ Каждый ион окружен сферическим электрическим полем, действующим на любой другой ион.
▼ Сила взаимодействия ионов определяются величиной их заряда и расстоянием между ними по закону Кулона.
▼ Ион окружает себя наибольшим числом ионов противоположного заряда в определенном порядке, позволяющем занять минимально возможный объем с минимальной потенциальной энергией.