Вопросы к экзамену по химии
1) Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Химия относится к естественным наукам, изучающим природу. Предмет изучения химии-вещества, их свойства, процессы взаимопревращения и явления, которыми они сопровождаются. Задачи химии как науки можно сформулировать следующим образом:1.изучение хим. Формы движения материи. 2.изучение законов, по которым эти материи движутся. 3.познание хим. Процессов и управление ими. 4.изучение физ. явлений, которыми эти процессы сопровождаются.
2) Химия играет исключительно важную роль в производственной деятельности человека. Природа дает нам лишь исходное сырье — дерево, руду, нефть и др. Подвергая природные материалы химической обработке, получают разнообразные вещества, необходимые для изготовления промышленных изделий, для сельского хозяйства, для строительства жилищ и производства товаров народного потребления. Химическая промышленность выпускает синтетический каучук, пластмассы, искусственное волокно, искусственное топливо, красители, лекарственные препараты, моющиеся средства и др. С использованием химических методов получают металлы, а также осуществляют их защиту от коррозии. Химические вещества помогают ускорить многие технологические процессы в пищевой и легкой промышленности.
Все существующее представляет собой различные виды движущейся материи, которая всегда находится в состоянии непрерывного движения, изменения, развития. Движение, как постоянное изменение, присуще материи в целом и каждой мельчайшей ее частице.
Каждый отдельный вид материи, обладающий при данных условиях определенными физическими свойствами, например вода, железо, сера, известь, кислород, в химии называют веществом.
3) Атомно-молекулярное учение:
1. Все вещества состоят из молекул.
2. Все молекулы состоят из атомов.
3. Молекулы и атомы находятся в непрерывном движении. Между ними действуют силы притяжения и отталкивания.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента, в отличие от сложных веществ.
Химический элемент – вид атомов, характеризующий определённый заряд ядра и строение электронных оболочек.
4) Атом – наименьшая частица элемента, сохраняющаяя все его химические свойства. Различным элементам соответствуют различные атомы.
Молекулы – наименьшие частицы вещества, обладающие его химическими свойствами.
Ион — одноатомная или многоатомная электрически заряженная частица вещества, образующаяся в результате потери или присоединения атомом в составе молекулы одного или нескольких электронов.
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
6) Любое определенное химически чистое соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами
7) Отношения масс веществ, вступающих в химическое взаимодействие, равны или кратны их химическим эквивалентам.
8) Если один и тот же элемент образует несколько соединений с другим элементом, то на одну и ту же массовую часть первого элемента будут приходиться такие массовые части второго, которые относятся друг к другу как небольшие целые числа.
9) Объемы вступающих в реакцию газов относятся друг к другу и у объемам образующихся газообразных продуктов реакции как небольшие целые числа.
10) В равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
11) Относительная атомная масса  – это масса атома, выраженная в атомных единицах массы, она показывает, во сколько раз масса атома данного элемента тяжелее 1/12 атома углерода 12С.
– это масса атома, выраженная в атомных единицах массы, она показывает, во сколько раз масса атома данного элемента тяжелее 1/12 атома углерода 12С.
Относительная молекулярная масса  вещества– масса молекулы, выраженная в атомных единицах массы.
вещества– масса молекулы, выраженная в атомных единицах массы.
Моль – это количество вещества, содержащее столько формульных единиц, сколько атомов содержится в 12 г изотопа углерода 12С.
Эквивалент (Э) – количество вещества, которое замещает в соединениях 1 моль атомов водорода или пол-моля атомов кислорода.
12) Оксиды — это сложные вещества, состоящие из двух видов химических элементов, одним из которых является кислород. Оксиды делятся на кислотные (в основном оксиды неметаллов) и основные (оксиды многих металлов). Кислотные оксиды реагируют с щелочами, в результате чего образуется соль. Соли также образуются в результате взаимодействия основного оксида с кислотой.
Основания — это сложные вещества, состоящие из атомов металла и гидроксогрупп (OH). Гидроксогруппа имеет валентность I, поэтому их количество в основании определяется валентностью металла. Например, NaOH — здесь одна гидроксогруппа, так как валентность натрия I. Ca(OH)2 — здесь валентность металла равна II, следовательно, к нему присоединяются две гидроксогруппы.
Основания, которые растворяются в воде, называются щелочами. Их можно получить при взаимодействии металла или его оксида с водой. Щелочи образуют наиболее активные металлы.
Все основания реагируют с кислотами с образованием соли и воды. Эта реакция называется реакцией нейтрализации.
Кислоты — это сложные вещества, состоящие из атомов водорода, которые могут замещаться на металл, и кислотных остатков. Кислотные остатки большинства кислот содержат атомы кислорода и другого какого-либо неметалла. Например, H2SO4, HNO3, H3PO4, H2CO3. Однако есть бескислородные кислоты — HCl, H2S, HBr.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Например, NaCl, CaCl2, K2SO4, CuSO4 и т. д. Соли можно рассматривать как результат замещения атомов водорода в кислоте на металл. Соли вступают в реакции обмена с другими солями, растворами кислот и щелочей. Более активный металл вытесняет из соли менее активный
13) Согласно принципам квантовой механики, состояние электрона в атоме характеризуется четырьмя так называемыми квантовыми числами: п, l, т и s, где п — главное квантовое число, в основном определяющее энергию электрона; l — орбитальное (побочное) квантовое число, характеризующее момент количества движения электрона; т — магнитное квантовое число, характеризующее проекцию момента количества движения электрона на некоторое выделенное направление, а именно — направление внешнего магнитного поля; s — спиновое квантовое число, характеризующее некоторый дополнительный момент количества движения электрона, присущий самому электрону.
14) Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. При увеличении главного квантового числа возрастает энергия электрона. Максимальное возможное значение главного квантового числа для электронов атома элемента равно номеру периода элемента.
15) Орбитальное квантовое число —квантовое число ℓ, определяющее форму распределения амплитуды волновой функции электрона в атоме, то есть форму электронного облака. Характеризует число плоских узловых поверхностей. Определяет подуровень энергетического уровня, задаваемого главным (радиальным) квантовым числом n и может принимать значения
L = 0;1;2;..; n-1
16) Магнитное квантовое число (m) — магнитное квантовое число характеризует ориентацию в пространстве орбитального момента количества движения электрона или пространственное расположение атомной орбитали. Оно принимает целые значения от -l до +l, где l — орбитальное квантовое число, то есть имеет ровно столько значений, сколько орбиталей существует на каждом подуровне.
17) Спиновое квантовое число – упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх 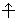 и вниз
и вниз  .
.
18) Единственный электрон атома водорода образует вокруг ядра сферическую орбиталь - шарообразное электронное облако, вроде неплотно намотанного клубка пушистой шерсти или ватного шарика. 
Сферическую атомную орбиталь ученые договорились называть s -орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и наконец превращается в гантелеобразную p -орбиталь:
 Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.

Все вместе три электронных облака, которые называют px -, py - или pz -орбиталями, образуют симметричную геометрическую фигуру, в центре которой находится атомное ядро. Она похожа на шестиконечный помпончик или на тройной бант - кому как нравится.
Итак, p -орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве - разное.
 Кроме s - и p -орбиталей, существуют электронные орбитали еще более сложной формы; их обозначают буквами d и f. Попадающие сюда электроны приобретают еще больший запас энергии, двигаются по сложным путям, и в итоге получаются сложные и красивые объемные геометрические фигуры.
Кроме s - и p -орбиталей, существуют электронные орбитали еще более сложной формы; их обозначают буквами d и f. Попадающие сюда электроны приобретают еще больший запас энергии, двигаются по сложным путям, и в итоге получаются сложные и красивые объемные геометрические фигуры.
Все d -орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре.
А пятая - вроде гантели, продетой в бублик.
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон.
19) Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1 s < 2 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 4 f  5 d < 6 p < 7 s < 5 f
5 d < 6 p < 7 s < 5 f  6 d...
6 d...
20) Каждая структура имеет минимально возможную для нее энергию, обеспечивающую устойчивость этой структуры. Принцип минимума энергии является своеобразным механизмом преобразования различных форм материи: избыточная энергия «консервируется» в виде вещества, связей новообразованных структур и энергетического поля (энергетической среды, в которой или с помощью которой происходит энергетический обмен в системах и поддержание стабильности).
21) Принцип Паули: на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Поэтому в атоме не должно быть двух электронов с одинаковыми четырьмя квантовыми числами (n, l, ml, ms)
22) Правило Хунда: заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
23) Правило Клечковского: Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел  . При одинаковой сумме раньше заполняется орбиталь с меньшим значением
. При одинаковой сумме раньше заполняется орбиталь с меньшим значением  .
.
24) Атомные ядра состоят из протонов и нейтронов. Протон — элементарная частица, обладающая массой 1,00728 а. е. м. и положительным зарядом, равным по абсолютной величине заряду электрона. Нейтрон также представляет собой элементарную частицу, но не обладающую электрическим зарядом; масса нейтрона составляет 1,00867 а. е. м. Протон принято обозначать символом - p, нейтрон — n.
Между образующими ядро частицами действуют два вида сил: электростатические силы взаимного отталкивания положительно заряженных протонов и силы притяжения между всеми частицами, входящими в состав ядра, называемые ядерными силами. С возрастанием расстояния между взаимодействующими частицами ядерные силы убывают гораздо более резко, чем силы электростатического взаимодействия. Поэтому их действие заметно проявляется только между очень близко расположенными частицами. Но при ничтожных расстояниях между частицами, составляющими атомное ядро, ядерные силы притяжения превышают силы отталкивания, вызываемые присутствием одноименных зарядов, и обеспечивают устойчивость ядер.
Атомы, обладающие одинаковым зарядом ядра (и следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом), называют изотопами.
25) Величина энергии, выделяющейся при образовании данного ядра из протонов и нейтронов, называется энергией связи ядра и характеризует его устойчивость: чем больше величина выделившейся энергии, тем устойчивее ядро.
Масса ядра всегда меньше суммы масс всех составляющих ядро частиц, т. е. всех протонов и нейтронов, рассматриваемых отделенными друг от друга. Это явление получило название дефекта массы.
26) В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Заряд ядра атомов химического элемента равен его порядковому номеру в Периодической таблице. Таким образом, 1) заряд ядра атома, 2) число протонов в ядре (Z), 3) число электронов в атоме и 4) порядковый номер элемента в периодической таблице — все эти четыре характеристики численно равны между собой.
27) В периодах слева направо радиусы атомов уменьшаются, особенно резко у s- и p-элементов, и менее заметно – у d-элементов. В периоде у всех элементов число энергетических уровней одинаково, но возрастанием заряда ядра увеличивается притяжение внешних электронов к ядру, это и приводит к уменьшению радиуса в периодеНаиболее характерным химическим свойством металлов является способность их атомов легко отдавать внешние электроны и превращаться в положительно заряженные ионы, а неметаллы, наоборот, характеризуются способностью присоединять электроны с образованием отрицательных ионов. Для отрыва электрона от атома с превращением последнего в положительный ион нужно затратить некоторую энергию, называемую энергией ионизации.
28) Атомы могут не только отдавать, но и присоединять электроны. Энергия, выделяющаяся при присоединении электрона к свободному атому, называется сродством атома к электрону. Сродство к электрону атомов металлов, как правило, близко к нулю или отрицательно; из этого следует, что для атомов большинства металлов присоединение электронов энергетически невыгодно. Сродство же к электрону атомов неметаллов всегда положительно и тем больше, чем ближе к благородному газу расположен неметалл в периодической системе; это свидетельствует об усилении неметаллических свойств по мере приближения к концу периода.
Электроотрицательность — способность атома в молекуле притягивать к себе электроны, участвующие в образовании химической связи.
Неметаллы характеризуются большой электроотрицательностью, металлы — небольшой (примерно 1,7 и меньше). При химическом взаимодействии валентные электроны смещаются к атому с большей электроотрицательностью. Величина относительной электроотрицательности элементов определяет многие свойства образованных ими веществ, такие, как полярность ковалентной связи, знак степени окисления, реакционная способность.
29) Основу теории, разработанной А. М. Бутлеровым, составляют следующие положения:
1. Атомы в молекулах соединены друг с другом в молекулы согласно их валентности, порядок распределения связей в молекуле называется химическим строением.
2. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
3. Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
4. Атомы в молекулах оказывают влияние друг на друга и это влияние приводит к химическим изменениям поведения атома.
5. Определить состав и строение химического элемента можно по продуктам химических превращений.
30) Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору)
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Водородные связи могут быть внутри- и межмолекулярными.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).
31) Метод валентных связей основывается на положении, что каждая пара атомов в химической частице удерживается вместе при помощи одной или нескольких электронных пар. Эти пары электронов принадлежат двум связываемым атомам и локализованы в пространстве между ними. За счет притяжения ядер связываемых атомов к этим электронам и возникает химическая связь. Метод приближенного решения электронного ур-ния Шрёдингера для многоэлектронных молекулярных систем. Основан на представлениях о двухцентровых хим. связях между атомами в молекуле, образуемых двумя электронами.
32) Общая электронная пара, осуществляющая ковалентную связь, может образоваться за счет неспаренных электронов, имеющихся в невозбуждеиных взаимодействующих атомах. Это происходит, например, при образовании таких молекул, как HCl,  ,
,  . Здесь каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара — возникает ковалентная связь.
. Здесь каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара — возникает ковалентная связь.
33) Образование ковалентной связи является результатом перекрывания валентных электронных облаков взаимодействующих атомов. Но такое перекрывание возможно только при определенной взаимной ориентации электронных облаков; при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Так, в молекуле водорода перекрывание атомных электронных облаков происходит вблизи прямой, соединяющей ядра взаимодействующих атомов (т. е. вблизи оси связи). Образованная подобным образом ковалентная связь называется сигма-связью.
При взаимодействии р-электронных облаков, ориентированных перпендикулярно оси связи, образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется пи-связью
34) Гибридизация является формальным приемом, применяемым для
квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной (гибридизованной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами. В результате гибридизации появляются новые гибридные орбитали которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. Поэтому тип гибридизации определяет геометрию молекулы или иона.
35) Основные понятия термодинамики.
Энергия - это такая характеристика движения и взаимодействия тел, которая связана с их способностью совершать изменения в состоянии системы и внешней среды.
Термодинамическая система – это ограниченная область пространства,занятая ее элементами.
Параметры состояния системы – это свойства, однозначно характеризующие однородные части системы.
Те из функций, которые не зависят от истории системы,т.е. от того, как она попала в данное состояние, называются функциями состояния.
Термодинамика – наука, изучающая взаимные переходы теплоты и работы в равновесных системах и при переходе к равновесию.
Термодинамика изучает:
1. Переходы энергии из одной формы в другую, от одной части системы к другой;
2. Энергетические эффекты, сопровождающие различные физические и химические
процессы и зависимость их от условий протекания данных процессов;
3. Возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях.
Объект изучения термодинамики – термодинамическая система - группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Системы бывают:
Изолированная система - система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система - система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система - система, которая обменивается с окружающей средой и веществом, и энергией.
Гомогенная система - система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система - система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Фаза - совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделённая от других частей системы видимыми поверхностями раздела.
Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы – термодинамические параметры. Опытным путем установлено, что для однозначной характеристики данной системы необходимо использовать некоторое число параметров, называемых независимыми; все остальные параметры рассматриваются как функции независимых параметров. В качестве независимых параметров состояния обычно выбирают параметры, поддающиеся непосредственному измерению, например температуру, давление, концентрацию и т.д. Всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния) есть термодинамический процесс.
Обратимый процесс - процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Равновесный процесс - процесс, при котором система проходит через непрерывный ряд равновесных состояний.
Энергия - мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве.
Внутренняя энергия системы - сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как её полную энергию за вычетом кинетической и потенциальной энергии системы как целого.
36) Нулевое начало термодинамики – макроскопическая система, находящаяся в неизменных внешних условиях, всегда приходит самопроизвольно в состояние термодинамического равновесия, которое характеризуется тем, что: прекращаются всякие макроскопические изменения в системе; каждый параметр, характеризующий макроскопическое свойство системы, имеет постоянное во времени значение;система, перешедшая в состояние термодинамического равновесия, сколь угодно долго остаётся в этом состоянии; для нарушения равновесия необходимы внешние воздействия.
37) Первое начало термодинамики: теплота подведённая к системе идёт на совершение работы и изменение её внутренней энергии.
38) Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Постулат Клаузиуса: «Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому» Другая формулировка второго начала термодинамики основывается на понятии энтропии: «Энтропия изолированной системы не может уменьшаться»
39) Энтропия - функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии.
Термодинамический смысл:
Понятие энтропии впервые было введено Клаузиусом в термодинамике для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при замкнутых обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
Математически энтропия определяется как функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы:
 ,
,
где  — приращение энтропии;
— приращение энтропии;  — минимальная теплота, подведённая к системе;
— минимальная теплота, подведённая к системе;  — абсолютная температура процесса.
— абсолютная температура процесса.
Статистический смысл:
Энтропия является функцией состояния, то есть не зависит от способа достижения этого состояния, а определяется параметрами этого состояния
Энтропия – вероятностная статистическая величина.
Энтропия замкнутой системы – максимальна, при достижении системой равновесного состояния.

где константа  1,38·10−23 Дж/К названа Планком постоянной Больцмана, а
1,38·10−23 Дж/К названа Планком постоянной Больцмана, а  — статистический вес состояния, является числом возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние.
— статистический вес состояния, является числом возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние.
40) Третье начало термодинамики может быть сформулировано так: «Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
41) Недостижимость абсолютного нуля температур: из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достичь ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
Поведение термодинамических коэффициентов: из третьего начала термодинамики вытекает ряд термодинамических следствий: при  должны стремиться к нулю теплоёмкости при постоянном давлении и при постоянном объёме, коэффициенты теплового расширения и некоторые аналогичные величины.
должны стремиться к нулю теплоёмкости при постоянном давлении и при постоянном объёме, коэффициенты теплового расширения и некоторые аналогичные величины.
42) При химических реакциях происходит взаимное превращение внутренней энергии веществ, с одной стороны, и тепловой, лучистой, электрической или механической энергии, с другой. Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается, — эндотермическими.
43) Важнейшей величиной в термохимии является стандартная теплота образования. Стандартной теплотой образования сложного вещества называется тепловой эффект реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую.
В термохимии также используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
44) Первый закон термохимии: тепловой эффект образования данного соединения в точности равен, но обратен по знаку тепловому эффекту его разложения.
45) Второй закон термохимии: тепловой эффект химической реакции не зависит от характера и последовательности отдельных ее стадий и определяется только начальными и конечными продуктами реакции и их физическим состоянием (при p=const или при v=const). Следствия:1) тепловой эффект химической реакции при р = соnst равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом стехиометрических коэффициентов; 2) тепловой эффект реакции горения равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов.
46) Внутренняя энергия вещества (или системы) — это полная энергия частиц, составляющих данное вещество. Она слагается из кинетической и потенциальной энергий частиц. Кинетическая энергия — это энергия поступательного, колебательного и вращательного движения частиц; потенциальная энергия обусловлена силами притяжения и отталкивания, действующими между частицами.
Энтальпия, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
47) Энергия Гиббса. Свободная энергия-это часть внутренней энергии, которая может быть превращена в работу при данных условиях. Энергия Гиббса характеризует ту часть полной энергии системы, которая может быть превращена в работу в изобарно-изотермическом (или в изохорно-изотермическом) процессе (так называемая полезная работа, совершаемая системой). Энергия Гиббса является функцией состояния системы, её абсолютное значение не поддаётся вычислению.
48) Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
49) Зависимость скорости реакции концентрацииреагирующих веществ: чем выше молярные концентрации исходных веществ в смеси, тем больше частиц содержится в ней и тем чаще эти частицы сталкиваются между собой, а это приводит к увеличению скорости реакции. При уменьшении молярных концентраций реагентов число сталкивающихся частиц становится меньше и скорость их взаимодействия понижается.
50) Химическая природа реагирующих веществ: поскольку химическая природа различных веществ неодинакова, они обладают разными химическими свойствами, разной реакционной способностью.для того,чтобы реакция протекала с заметной скоростью, неактивные частицы нужно перевести в активное состояние, сообщив им недостающую энергию. Эта энергия называется энергией активации
51) Зависимость скорости реакции от температуры (правило Вант-Гоффа): при повышении температуры на каждые 10 градусов Цельсия скорость большинства химических реакций увеличивается в 2-4 раза.
52) Энергия активации-минимальная энергия,которую необходимо сообщить неактивным частицам реагирующих веществ для перевода их в активное состояние. Активированный комплекс, группировка атомов в решающий момент элементарного акта химической реакции.
53) Вещества, которые участвуют в реакц