ГБПОУ РК «Керченский политехнический колледж»
| «УТВЕРЖДАЮ» Зам. директора по УР ____________ С.В. Казак «___» _________2020 г. |
Экзаменационные вопросы к экзамену (квалификационному)
по ПМ 01 Определение оптимальных средств и методов анализа природных и промышленных материалов
Специальность: 18.02.01 Аналитический контроль качества химических
соединений
1. Основной закон фотометрии.
2. Визуальная колориметрия фотоэлектроколориметр.
3. Основные приёмы фотометрических измерений.
4. Спектрофотометрический метод анализа.
5. Нефелометрический метод анализа.
- Турбидиметрический метод анализа.
- Качественный и количественный люминесцентный анализ.
- Явления поляризации. Виды поляризации.
- Рефрактометрические методы измерения.
- Кондуктометрический метод анализа.
- Потенциометрический метод анализа.
- Электроды потенциометрии.
- Кулонометрический метод анализа. Закон Фарадея.
- Методы количественного полярографического анализа.
- Особенности амперометрического титрования.
- Газовая хроматография.
- Жидкостная хроматография.
18. Планарная хроматография.
19. Тонкослойная хроматография.
20. При идентификации аминокислот в концентрате из белкового гидролизата фронт растворителя (смесь н-бутанола, уксусной кислоты и воды) переместился от центра хроматографической бумаги на 55 мм. После опрыскивания хроматограммы раствором нингидрина получили три синих концентрических кольца с центрами, удаленными от стартовой линии на 20, 25 и 45 мм. В идентичных условиях хроматографировали растворы аминокислот и получили следующие коэффициенты подвижности: аспарагиновая кислота – 0,24, глутаминовая кислота – 0,36, лизин – 0,46, валин – 0,64, аланин – 0,82, тирозин – 0,90. Какие аминокислоты содержатся в концентрате из белкового гидролизата?
21. Через колонку с катионитом в Н+ – форме пропустили 20,00 мл раствора KCl. Элюат оттитровали 15,00 мл 0.1 М раствора NaOH. Определить содержание KCl в анализируемом растворе.
22. Через колонку, содержащую 5,0г катионита, пропустили 250,0 мл 0,050М раствора ZnSO4. Вытекающий из колонки раствор собирали порциями по 50,0 мл, в каждой порции определяли содержание ионов цинка и получили следующие значения концентрации (моль/л): 1 – 0,008; 2 – 0,029; 3 – 0,038; 4 – 0,050; 5 – 0,050. Определить полную динамическую емкость (ммоль/г) катионита
23. Определить массовую долю (%) метана и этана в газовой смеси, если площади хроматографических пиков и поправочные коэффициенты этих компонентов равны, соответственно: 80 мм 2 и 1.23 мм 2, 40 мм 2 и 1.15 мм 2.
24. При амперометрическом определении содержания цинка в литейной бронзе навеску сплава массой 1,456 г растворили и перевели раствор в мерную колбу на 200 мл. 15мл. приготовленного раствора цинка амперометрически оттитровали свежеприготовленным раствором K4[Fe(CN)6] с титром по цинку равным 0,002655 г/мл. При титровании получены следующие данные
| Объём титранта,мл | ||||||||||||||||
| 0,2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 | 1.2 | 1.5 | 1.6 | 2.0 | 2.1 | 2.5 | 2.7 | |
| Ток, мА |
Результаты амперометрического титрования цинка раствором ферроцианида калия Построить график по результатам титрования и вычислить массовую долю цинка в анализируемом образце сплава.
25. При полярографировании растворов одинаковых навесок стандартных образцов стали, содержащей никель, были получены следующие данные по высотам полягрофических волн в таблице. Высота полярографической волны лдя исследуемого раствора hх оказалась равной 26. Определить массовую долю вещества.
| Ѡ, Ni,% | 0,1 | 1,1 | 0,2 | 2.2 | 0,3 | 3,4 | 0,4 | 4.4 | 0,55 | 5,6 |
| hэ, мм |
26. Определить рентабельность электролиза, если при пропускании тока силой 2,5 А в течение 2 часов через раствор медного купороса CuSO4 на катоде выделилось 5,88 г меди.
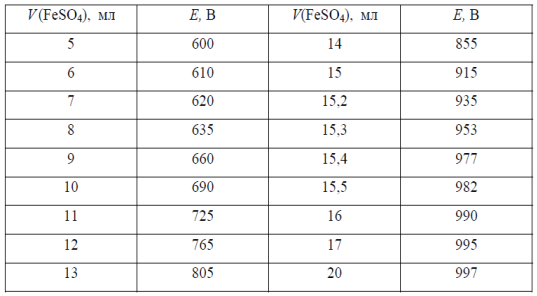
27. В навеске сплава массой 1,2500 определяли содержание хрома потенциометрическим титрованием. При растворении сплава хром окислили до хромовой кислоты H2CrO4. Титрование проводили раствором сульфата железа (II) с концентрацией Т(FeSO4/Cr) = 0,005020 г/мл. Вычислить массовую долю (масс. %) хрома в сплаве по следующим данным потенциометрического титрования.
таблица 1 Результаты потенциометрического титрования хрома (VI) рабочим раствором железа (II)
28. Рассчитать потенциал серебряного электрода, опущенного в раствор нитрата серебра AgNO3 с активностью 0,429 моль/1000 г воды. Величина стандартного электродного потенциала серебряного электрода равна 0,799 В.
29. Удельная электрическая проводимость раствора 0,02 н раствора хлорида калия при 20°С 0,25 См/м. табличные данные К+ (6,37) и С1- (6,63). Вычислить кажущуюся степень диссоциации хлорида калия в данном растворе.
30. Для рефрактометрического определения бихромата калия K2Cr2O7 были приготовлены семь стандартных растворов с определенным содержанием бихромата, г/100 мл раствора (Концентрация K2Cr2O7, г/100 мл 1,0141 2,0618 3,0649 4,0562 5,0497 6,0097 7,0103. Оптическая плотность 1,3350 1,3367 1,3385 1,3403 1,3420 1,3420 1,3455 проба 1,3375). При помощи рефрактометра были определены показатели преломления каждого из стандартных растворов, результаты рефрактометрирования. Затем был определен показатель преломления анализируемой пробы. По полученным результатам построить градуировочный график зависимости показателей преломления от содержания бихромата калия в растворе. Определить содержание бихромата калия в исследуемой пробе.
31. При построении калибровочного графика для винной кислоты были получены следующие данные на клиновом поляриметре:
Концентрация растворов винной кислоты, %. 10 20 30 40
Показания поляриметра, мм....... 9,9 19,1 27,3 34,9
Сколько граммов винной кислоты надо растворить в 250 мл воды, чтобы отсчет по шкале поляриметра был 23,5 мм.
32. При анализе пробы массой 0,9816 г на содержание кобальта хемилюминесцентным фотографическим методом на одну фотопластинку снимали свечение пробы анализируемого раствора, стандартов и холостого опыта. В ячейки кюветы помещали по 0,5 мл раствора соли кобальта, прибавляли салицилат натрия (для устранения мешающего действия катионов меди и железа) и одинаковое количество перекиси водорода. Значение ΔS стандартных растворов, содержащих 4,0; 8,0; 12,0; 16,0 мкг/мл кобальта, составили 0,17; 0,28; 0,40; 0,53 соответственно. Вычислите массовую долю (%) кобальта в пробе, если ΔSх =0,20.
33. Турбидинамическим методом определить концентрацию магния в анализируемом растворе. Взять навеску 0,1997 г МgCl2 перенести в мерную колбу вместимостью 50,0 мл и довести раствор до метки. Для построения градуировочного графика отобрать объемы Vn этого раствора, которые после добавления стабилизирующего коллоида необходимых реагентов довести водой до100,0мл, а затем измерить кажущиеся оптические плотности раствора (табл.).
Таблица
| V n, мл | ||||
| А | 0,25 | 0,35 | 0,45 | 0,56 |
34. Методом турбидиметрического титрования навеску 0,5369 г анализируемого вещества (Sr (II)) поместить в мерную колбу вместимостью100,0 мл и довести объем до метки дистиллированной водой. Затем взять аликвоту15,0 мл, добавить реагенты и оттитровать 0,0500 М (NН4)2C2О4. Построить кривую титрования и определить массовую долю Sr (II)(%) в образце по результатам измерений
Для определения Sr (II)в образце методом фототурбидиметрического титрования навеску0,5369 г анализируемого вещества поместили в мерную колбувместимостью100,0 мл и довели объем до метки дистиллированной водой. Затем взяли аликвоту15,0 мл, добавили необходимые реагенты и оттитровали0,0500 М (NН4)2C2О4. Построить кривую титрования и определить массовую долюSr (II)(%) в образце по результатам измерений, приведенным в табл.
Таблица
| V ((NН4)2C2О4), мл | 1,5 | 2,5 | 3,5 | 4,5 | 5,5 | 6,5 | 7,5 |
| А | 0,3 | 0,4 | 0,5 | 0,6 | 1,1 | 1,7 | 2,2 |
35. Для спектрофотометрического определения хрома были приготовлены 6 стандартных растворов с содержанием хрома 0.04, 0.08, 1.00, 2.00, 3.00, 5.00 мг/л соответственно. При помощи спектрофотометра были определены их оптические плотности, результаты которых были внесены в таблицу. Затем была определена оптическая плотность анализируемой пробы, значение которой также было занесено в таблицу. По полученным результатам построить градуировочный график зависимости оптических плотностей от концентрации хрома в растворе.
Оптическая плотность 0,025 0,051 0,066 0,137 0,203 0,336 проба 0,190
Определить концентрацию пробы.
36. 0,2500г стали растворили в 100 мл, отобрали пробы по 25 мл в две колбы. В первую добавили стандартный раствор, содержащий 0,50 мг титана, затем в каждую колбу добавили реактивы для получения окрашенных соединений титана и разбавили до 50 мл. Измерение значения оптической плотности: А1 = 0,650, А2 = 0,25. Рассчитать массовую долю титана в стали.
37. При фотоколориметрическом определении урана с пероксидом водорода кислотой из стандартного раствора приготовили ряд разведений в мерных колбах вместимостью 100 см3, измерили оптическое поглощение и получили следующие данные:
Vст, см3 1,0 2,0 3,0 4,0 5,0 6,0
А 0,12 0,25 0,37 0,50 0,62 0,75
Определите сколько воды необходимо прибавить к 100 г 25%-ного раствора урана с пероксидом водорода, чтобы получить 5%-ный раствор?
При построении графика определите концентрацию UO22+ в анализируемых
растворах, если их оптическое поглощение равно 0,30 и 0,50.
38. Молярный коэффициент светопоглощения стронция при 297нм 31500. Какое минимальное содержание стронция (%) можно определить в навеске 2г., растворенной в мерной колбе 250мл, если минимальное значение оптической плотности, измеренное в кювете с толщиной слоя 5 см, равно 0,025?
| Рассмотрено и одобрено на заседании предметной цикловой комиссии механических и химико-технологических дисциплин Протокол №___от «____» _______2020г. Председатель ПЦК _______________ Ю.А. Письменный | Разработал преподаватель __________ О.В. Михайличенко |