Лекция № 5
Электрофорез
1. Принцип электрофореза.
2. Электрофорез с подвижной границей.
3. Зональный электрофорез.
4. Изоэлектрическая фокусировка.
Белки, нуклеиновые кислоты, полисахариды, находясь в растворе несут определенный электрический заряд благодаря наличию групп, способных к электролитический диссоциации. Общий заряд данной частицы определяется, прежде всего, концентрацией Н+-ионов в среде. Под действием электрического тока заряженные частицы перемещаются к катоду или аноду в зависимости от знака их суммарного заряда. Такое явление носит название электрофореза. Скорость движения частиц (см/с) при напряженности электрического поля 1 В/см называется электрофоретической подвижностью. Она имеет размерность см2/с-1·в-1.
Различия в подвижности частиц служат основой для разделения смесей веществ.
Если приложить к электропроводящему раствору равномерное электрическое поле (Е), то на частицу будет действовать сила ускорения:
F=Е/d·q
где d – расстояние между электродами, q – заряд молекулы. Так как молекула перемещается не в вакууме, то на неё действует противоположно направленная сила трения, которая зависит от размеров, формы молекулы, вязкости среды и описывается уравнением Стокса:
F = f·v,
где f – коэффициент трения, v – скорость движения молекулы. Для сферических частиц коэффициент трения равен 6πηr, где r – радиус частиц и η – коэффициент вязкости растворителя. В растворе силе ускорения противодействует сила трения, поэтому:
Е/d·q = 6πηrv, преобразуя выражение, получим:
V = Eq/6πdηr.
Таким образом, скорость молекулы (v) пропорциональна напряженности электрического поля Е/d и заряду молекулы и обратно пропорциональна размеру молекулы и вязкости среды. Заряд и размер являются строго индивидуальными характеристиками молекулы. Следовательно, и путь, который пройдет та или иная молекула при электрофорезе за определенный интервал времени, тоже будет характерен для данной молекулы.
Существуют три основных типа электрофоретических систем – электрофорез с подвижной границей, зональный электрофорез и стационарный электрофорез.
Элекрофорез с подвижной границей
Электрофорез макромолекул, растворенных в буфере с соответствующим значением рН, проводится в V-образной кювете с прямоугольным поперечным сечением. Раствор макромолекул в буфере заливают в нижнюю часть кюветы, доливают оба конца трубки тем же буфером и монтируют в них электроды. Если вести электрофорез в щелочном буфере, то все белки заряжаются отрицательно и начинают перемещаться к аноду: скорость перемещения данного белка зависит от его рН, и от величины суммарного заряда при данном рН буфера. Как видим, в данном методе электрическое поле прикладывается к исходно разной границе между раствором молекул и буфером. Скорость миграции заряженных частиц определяется путем наблюдения за перемещением этой границы. Если раствор содержит гетерогенную смесь ионизированных макромолекул, то можно увидеть множество движущихся границ. Способы наблюдения за пограничными изменениями концентрации вещества основаны на измерении градиента показателя преломления, который пропорционален градиенту концентрации.
Сконструирование Филпонтом и Свенссоном астигматической фотокамеры со специальной оптической системой, называемой шлирен-оптикой, позволяет непосредственно регистрировать градиент показателя преломления вдоль кюветы.
Электрофорез по методу подвижной границы нашел широкое применение при исследовании белков. Этот метод в основном используется для определения подвижностей и изоэлектрических точек белков, т.к. количественно трудно оценить подвижности. Метод электрофореза с подвижной границей используется редко.
Зональный элекрофорез
В зональном электрофорезе пятно или тонкий слой раствора, нанесенного на полутвердый или гелеобразный материал, помещают в электрическое поле, в результате чего молекулы перемещаются по или через материал носитель. В первую очередь функцией носителя является предотвращение механических воздействий и конвекции, которая происходит в результате температурных или высокой плотности концентрированных растворов.
Однако, носитель может действовать в качестве молекулярного сита, приводя тем самым к хроматографическим эффектам, что может или улучшить разделение, или ухудшать его.
а) электрофорез на бумаге.
В качестве носителя здесь используется фильтровальная бумага, которая должна содержать 96% α-целлюлозы, нерастворимой в концентрированном растворе NaOH. Приборы для электрофореза состоят из двух электродных сосудов и устройства для поддержания полосок фильтровальной бумаги. В качестве электродов обычно применяются платиновые проволоки. Можно использовать и угольные электроды. Для предотвращения чрезмерного испарения всю систему помещают в закрытую камеру, что обеспечивает создание влажной атмосферы.
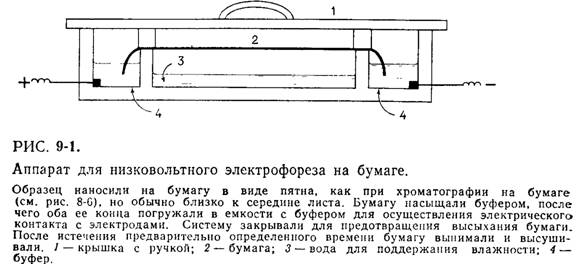
Перед анализом электрофоретическую бумагу погружают в буферный раствор, слегка промокают между чистыми листами промокательной бумаги, а затем помещают на подставку.
Пробу наносят либо капиллярной пипеткой с закрученным носиком, либо с помощью различных аппликаторов, обеспечивающих быстрое и равномерное нанесение исследуемого раствора.
После нанесения проб к кювете подключают напряжение. Для наблюдения за ходом электрофореза на бумагу наносят пятно определенного стандартного вещества. По окончании процедуры бумагу высушивают при 105-110°С. Макромолекулы затем можно обнаружить при помощи соответствующего метода окрашивания.
Б) электрофорез в ПААГ.
В качестве среды для электрофоретического разделения макромолекул наиболее широкое распространение получил ПААГ, обладающий рядом преимуществ. Среди них можно отметить химическую стабильность, инертность, прозрачность в широком диапазоне длин волн, возможность получения пор с заданной величиной, отсутствием адсорбции. С помощью ПААГ можно разделить вещества с молекулярной массой от 2500 до 2000000 дальтон.
Системы электрофореза в ПААГ можно разделить на две группы по применяемым буферным системам. К первой относятся системы вертикального и горизонтального электрофореза, в которых применяется один тип буфера в электродных камерах и геле. Ко второй группе относятся системы вертикального «диск-электрофореза»: в них используются разные виды буферов (2-3) и гели разной концентрации. Название данного метода происходит от английского слова discontinuty (прерывистый), обозначающего в данном контексте неоднородность электрофоретической среды. Для диск-электрофореза характерны скачкообразные изменения рН, концентрации геля и градиента напряжения.
Прибор для диск-электрофореза состоит из верхнего и нижнего резервуара для электродного буфера и вертикальной стеклянной трубки. Нижняя часть трубки заполняется разделяющим гелем с мелкими порами, которые действуют как молекулярное сито по отношению к изучаемым макромолекулам. Над разделяющим гелем находится концентрирующий гель, имеющий крупные поры и поэтому не обладающий свойствами молекулярного сита, а еще выше расположен стартовый гель, содержащий пробу и краситель, используемый в качестве свидетеля.
Принцип диск-электрофореза основан на эффекте подвижной границы Кольрауша, суть которого состоит в использовании двух разных буферов: в электродных камерах трис-глициновый буфер (рН 8,3), а в концентрирующих(рН 6,7) и разделяющем гелях(рН 8.9) – трис-НСl. В электродном буфере рН на 1,5-2 единицы выше, чем в концентрирующем. Образец растворяется в том же буфере, который используется в концентрирующем геле. При рН 8,3 глицин находится в виде цвиттериона:
+NH3CH2COO- ↔ NH2-CH2-COO- + H+
После включения тока все ионы (в том числе белки и краситель) начинают двигаться к аноду в следующей последовательности: Сl-> бромфеноловый синий > белки > глицинат.
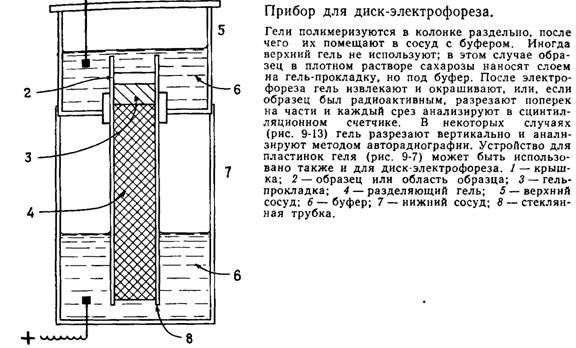
Рис. 1. Прибор для диск-электрофореза.
Между ионами хлора и глицината образуется граница раздела. Так как оба эти иона принадлежат к одной и той же электрической системе, то в области глицинатных ионов напряжение, а следовательно, и их скорость, возрастают, а в области ионов хлора напряжение и скорость уменьшаются. Следовательно, замыкающие глицинатные ионы будут стремиться догнать ведущие ионы хлора, а зона белков и красителя, находящаяся между ними, будет сужаться (концентрироваться). Этот процесс происходит в концентрирующем (крупнопористом) геле.
Когда подвижная граница доходит до мелкопористого геля (рН 8,9), то, с одной стороны, подвижность глицинатных ионов возрастает, а с другой – на белки начинает действовать эффект молекулярного сита, и они отстают от подвижной границы. Таким образом, белки попадают в более щелочной трис-глициновый буфер, их отрицательный заряд возрастает, и они разделяются согласно своим индивидуальным характеристикам (заряду, форме молекул, молекулярному весу).
При проведении электрофореза гель полимеризуется непосредственно в стеклянной трубке, которую потом соединяют с сосудами с буфером. Образец суспендируют в концентрированном растворе сахарозы и наносят на поверхность геля в виде тонкого слоя с помощью пипетки. Электрофорез прекращают, когда зона красителя (подвижная граница) проходит 0,8-0,9 длины геля. Затем гель извлекают из трубки и окрашивают специальными красителями обнаружения зон. Каждую зону можно характеризовать по значениям их Rf или по площади пика после денсатометрирования. Диск-электрофоретический метод особенно часто используется для разделения белков.


