Расчет растворимости труднорастворимых электролитов по табличной величине произведения растворимости. Расчет произведения растворимости по заданной концентрации раствора.
В насыщенных растворах малорастворимых сильных электролитов произведение активностей ионов этих электролитов в степенях стехиометрических коэффициентов есть величина постоянная для данной температуры, называемая произведением растворимости ПР. В случае разбавленных растворов с малой ионной силой (например, в отсутствие других электролитов) можно принять g i » 1 и ci = ai. Тогда для электролита
A n B m ® n Am+ + m Bn-
ПР = a A m + na B n - m =(gА m+c A m +) n (gB n-cBn-) m = c A m + n . c B n - m.
Растворимость вещества с Р связана с ПР соотношением
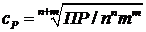 .
.
Таким образом, зная ПР (см. табл. приложение 4 [1]), можно рассчитать растворимость и наоборот. Используя справочные величины ПР, легко определить можно ли приготовить раствор заданной концентрации.
Пример 1. Рассчитайте произведение растворимости сульфида мышьяка As2S3, если растворимость этого соединения в воде составляет 2,15×10-5 г/100 г Н2О.
Решение. Выразим величину растворимости в [моль/л], принимая плотность очень разбавленного насыщенного раствора равной 1 г/см3 и молярную массу M (As2S3) = 264 г/моль: c Р = 2,15×10-5×1000/264×100 = 8,1×10-7 (моль/л). Из уравнения диссоциации сульфида мышьяка определим молярную концентрацию ионов в насыщенном растворе, учитывая полный распад на ионы сильного электролита:
Аs2S3 ® 2As3+ + 3S2-,
откуда [As3+] = 2 c Р и [S2–] = 3 c Р.
Поскольку растворимость соли чрезвычайно мала и другие ионы в растворе отсутствуют, ионная сила такого раствора I ® 0, коэффициенты активности ионов g i ® 1 и активности ионов а i » сi. . Тогда, по определению,
ПРAs S = (a As3+)2×(a S2-)3 = [As3+]2 [S2–]3 = (2 c Р)2×(3 c Р)3 = 108 с Р5 = 3,8×10-29, что согласуется с табличной величиной ПР.
Пример 2. Рассчитайте растворимость соединения ВаF2 в воде и в 0,1 М растворе NaF, если ПР(BaF2) = 1,1×10-6.
Решение. 1) Учитывая относительно малую величину ПР, можно в 1-м приближении при отсутствии других ионов в растворе считать активности ионов Bа2+ и F- равными их концентрации: a Ba2+ » [Ba2+] и a F-» [F–].
Из уравнения диссоциации сильного электролита:
BаF2 ® Bа2+ + 2F-
следует, что в насыщенном растворе [Ba2+] = c Р и [F–] = 2 c Р,
где c Р - растворимость BаF2. Тогда по определению:
ПР = (a Ba2+) × (a F-)2 = [Ba2+] [F–]2 = (с Р)×(2 с Р)2 = 4 c P3 = 1,1×10-6.
Откуда с Р =  = 6,5.10-3 моль/л.
= 6,5.10-3 моль/л.
2) Поскольку активности ионов в насыщенном растворе электролита при постоянной температуре могут меняться лишь таким образом, чтобы произведение растворимости оставалось постоянным, то при увеличении концентрации (активности) одного из ионов путем введения в раствор хорошо растворимой соли, содержащей данный ион концентрация (активность) другого иона резко снизится. При этом растворимость электролита в целом определяется концентрацией иона, который присутствует в меньшем количестве.
В нашем случае активность ионов F- в 0,1 М растворе NaF составит примерно: a F- = gF-[F-] = 0,8.0,1 = 8.10-2,
а активность ионов Ва2+: a Ba2+ =ПР/(a F)2 = 1,1.10-6/6,4.10-3 = 1,7.10-4.
Откуда с Р = [Ba2+] = 1,7.10-4/gВа2+ =1,7.10-4/0,3 = =5,7.10-4 моль/л.
Таким образом, растворимость плохо растворимой соли уменьшается в присутствии хорошо растворимого электролита, содержащего общий ион с этой солью.
Пример 3. Определите, можно ли приготовить раствор Са(ОН)2 концентрации с = 2×10-3 моль/л, если при 25oС ПР(Са(ОН)2) = 6×10-6.
Решение. Для ответа на подобный вопрос в общем случае для электролита A n B m следует определить произведение активностей ионов заданной концентрации по формуле ПА = a A m + n. a B n - m, а затем сравнить полученную величину со справочным значением ПР. Если ПА > ПРтабл, то раствор такой концентрации приготовить нельзя (избыток ионов окажется в твердой фазе). Если же рассчитанное ПА < ПРтабл, то заданное количество вещества можно растворить полностью.
Определим молярную концентрацию ионов в заданном растворе из уравнения диссоциации:
Са(ОН)2 ® Са2+ + 2ОН-;
[Ca2+] = с (Са(ОН)2) = =2×10-3 моль/л;
[OH-] = 2 с (Ca(OH)2)= 4×10-3 моль/л.
Рассчитаем ионную силу раствора:
I = ½ (с Са2+ z 2Ca2+ + c OH- z 2OH-) = ½ (2×10-3×4 + 4×10-3×1) = 8×10-3.
По правилу ионной силы определим коэффициенты активности ионов в таком растворе по табл. Имеем для двухзарядных ионов gCa2+= gM2+ » 0,61; для однозарядных gOH- = gA- » 0,93. Найдем произведение активностей ионов для раствора требуемой концентрации:
ПА = a Ca2+(a OH-)2 = gCa2+[Ca2+](gOH-[OH–])2= 0,61×2×10-3(0,93×4×10-3)2 =1,69×10-8.
Полученная величина ПА существенно меньше табличного значения ПР, следовательно, вещество растворится полностью и раствор 2×10-3 М Са(ОН)2 можно приготовить.
Пример 4. Рассчитайте рН насыщенного раствора Са(ОН)2. Найдем растворимость Са(ОН)2 по известному ПР(Са(ОН)2) = 6×10-6.
с Р =  = 1,4.10-2 (моль/л)
= 1,4.10-2 (моль/л)
Из уравнения диссоциации сильного электролита:
Са(ОН)2®Са2++2OH-
следует, что в насыщенном растворе [Ca2+] = c Р и [OH–] = 2 c Р,
где c Р - растворимость Са(ОН)2.
Тогда рН = 14-рОН= 14+lgсОН=14+lg2 c Р= 12,43
Пример 5. Выпадет ли осадок при сливании двух растворов: a)20 мл 0,001 М КОН и 10 мл 0,001М CaCl2; б)20 мл 0,001 М КОН и 10 мл MgCl2.
Решение.
а) уравнение реакции: CaCl2 + 2КОН = Са(ОН)2↓+ 2КCl Осадок выпадет, если произведение активности соответствующих ионов в образовавшемся растворе(ПА) превысит ПР малорастворимого соединения, то есть ПА>ПР=6.10-6 Для простоты примем активность ионов равными концентрации. (То есть должно выполняться неравенство ПК>ПР)
Суммарный объем образовавшегося раствора: V = 10+20 = 30мл. Концентрация иона Са2+ в новом растворе после сливания:
с Са2+ = 0,001.001/0,03=3,3.10-4(моль/л);
концентрация иона ОH-: с ОH- = 0,001.0,02/0,03=6,6.10-4(моль/л).
Находим ПК: (3,3.10-4).(6,6.10-4)2=1,43.10-10<6.10-6, следовательно, выпадения осадка не будет.
б) аналогично предыдущему получаем ПК(Mg(OH)2)= 1,43.10-10> ПР(Мg(ОН)2) =5,5 . 10-12 следовательно, осадок выпадет.
Пример 6. В каком объеме воды можно растворить 1 г сульфида меди?
Решение. Согласно справочным данным ПРСuS = 4×10-38.Учитывая необратимость диссоциации сильного электролита:
СuS ® Сu2+ + S2- и чрезвычайно малую его растворимость можно записать выражение для ПР:
ПР = a Cu2+ . a S2- » [Cu2+] [S2-] = c Р× c Р = c Р2,
где c Р - растворимость сульфида меди.
Тогда с Р = Ö ПР = 2.10-19 моль/л.
Определим число молей СuS в 1г этой соли.
Поскольку М СuS=64+32=96 г/моль, nСuS = 1/96 = 1,04×10-2 моль. Определим объем раствора, в котором может содержаться 1,04×10-2 моль СuS с учетом найденной растворимости:
в 1 л насыщенного раствора содержится 2×10-19 моль СuS, в х л - содержится 1,04×10-2 моль.
Решая пропорцию, получаем х = 1,04×10-2/2×10-19= 5,2×1016 (л). Учитывая малое содержание соли, можно объем раствора приравнять к объему воды, т.е. 1 г СuS можно растворить в 5,2×1016 литрах Н2О.
Следует иметь в виду, что при введении в раствор хорошо растворимого электролита, не имеющего общих ионов с малорастворимым соединением, растворимость последнего повышается, поскольку при этом уменьшаются коэффициенты активности ионов, а ПР остается постоянным. Это достигается в результате увеличения концентрации соответствующих ионов
в растворе, для чего некоторое их количество переходит из твердой фазы в раствор. Повышение растворимости малорастворимых соединений может происходить и при введении в раствор ионов, входящих в состав этого соединения, в результате образования комплексов. Например, осадок AgCl растворяется в избытке KCl вследствие образования хорошо растворимой комплексной соли K[AgCl2], а малорастворимый гидроксид цинка Zn(OH)2 растворяется в избытке КОН в результате образования комплексного основания K2[Zn(OH)4].