Большинство процессов представляют собой два одновременно происходящих явления: передачу энергии и изменении в упорядоченности расположения частиц относительно друг друга. Мерой неупорядоченности среди частиц в системе служит функция состояния называемая энтропия S. В отличие от других функций состояния, можно определить не только изменение энтропии D S, но и абсолютное значение энтропии S.
Абсолютное значение энтропии можно вычислить по уравнению Больцмана ( ): S = R ×ln W,
): S = R ×ln W,
где R - универсальная газовая постоянная; W - термодинамическая вероятность, которая показывает число микросостояний системы, при помощи которых может реализоваться определенное макросостояние.
При переходе вещества из твердого состояния в жидкое и далее в газообразное значительно увеличивается неупорядоченность частиц, поэтому S газа >> S ж > S тв . У веществ в аморфном состоянии энтропия будет больше, чем в кристаллическом, так как кристалл более упорядоченная структура. Например, для стекловидного и кристаллического SiO2 значения энтропии равны 46,9 и 42,7  соответственно. При одинаковом агрегатном состоянии энтропия тем выше, чем больше атомов содержится в молекуле. Так, энтропии газообразных О, О2 и О3 равны соответственно 161, 205 и 239
соответственно. При одинаковом агрегатном состоянии энтропия тем выше, чем больше атомов содержится в молекуле. Так, энтропии газообразных О, О2 и О3 равны соответственно 161, 205 и 239 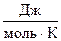 .
.
Энтропии многих веществ определены при стандартных условиях и приведены в справочной литературе (см. приложение). Энтропию при этих условиях называют стандартной энтропией и обозначают S  .
.
Расчет D S  химической реакции осуществляют так же, как и изменение энтальпии реакции. Для реакции общего вида a A + b B = d D + f F
химической реакции осуществляют так же, как и изменение энтальпии реакции. Для реакции общего вида a A + b B = d D + f F
D S  = d S
= d S  (D) + f S
(D) + f S  (F) - a S
(F) - a S  (A) - b S
(A) - b S  (B).
(B).
Об изменении энтропии в химической реакции можно судить по изменению объема системы в ходе реакции. Если объем системы увеличивается, то D S  > 0, а если реакция протекает с уменьшением объема, то энтропия также уменьшается (D S
> 0, а если реакция протекает с уменьшением объема, то энтропия также уменьшается (D S  < 0). Для реакций между твердыми веществами изменения энтропии практически не происходит. То же относится и к процессам, в которых число моль газообразных веществ не изменяется.
< 0). Для реакций между твердыми веществами изменения энтропии практически не происходит. То же относится и к процессам, в которых число моль газообразных веществ не изменяется.
Процессы, протекающие без подвода энергии от внешнего источника, называют самопроизвольными. Согласно второму закону термодинамики, в изолированной системе самопроизвольно идут только такие процессы, которые сопровождаются увеличением энтропии. Таким образом, знак D S является критерием направления протекания процессов в изолированных системах.
Если D S > 0, то процесс протекает самопроизвольно в прямом направлении, при D S < 0 направление самопроизвольного протекания процессов обратное. В случае, когда D S = 0, изолированная система находится в состоянии равновесия.
Пример 1. Какой знак будет иметь изменение энтропии для реакции
N2, г + 2О2, г = 2NO2, г?
Сопоставьте вывод с результатами расчетов, если S  участников реакции равны: N2 - 191,5; O2 - 205,0; NO2 - 240,2
участников реакции равны: N2 - 191,5; O2 - 205,0; NO2 - 240,2  .
.
Р е ш е н и е
Данная реакция протекает с уменьшением числа моль газов (в исходных веществах - 3 моль, а в продуктах - 2 моль), то есть с уменьшением объема. Поэтому ожидаем, что D S  < 0. Вычислим изменение энтропии в стандартных условиях
< 0. Вычислим изменение энтропии в стандартных условиях
D S  = 2 S
= 2 S  (NO2) - S
(NO2) - S  (N2) - 2 S
(N2) - 2 S  (O2) =
(O2) =  .
.
По результатам расчета получили также D S  < 0.
< 0.
Пример 2. Укажите знак изменения энтропии при плавлении льда.
Р е ш е н и е
При плавлении льда вода из твердого состояния переходит в жидкое. Поскольку S ж > S тв, то D S пл = S ж - S тв > 0.
З А Д А Ч И
1. Определите изменение энтропии в стандартных условиях для реакции
2Сграфит + Н2, г = С2Н2, г.
2. В каком направлении протекает реакции в изолированной системе
Сграфит + СО2, г = 2СОг.
3. Объясните, как изменяется упорядоченность частиц в системе при диссоциации воды на ионы, если D S  процесса диссоциации равно ‑72,8
процесса диссоциации равно ‑72,8  .
.
4. Вычислив D S  реакций, определите, какая из двух протекает в прямом направлении в изолированной системе:
реакций, определите, какая из двух протекает в прямом направлении в изолированной системе:
1) FeO + CO = Fe + CO2; 2) FeO + H2 = Fe + H2Oг.
5. Вычислите изменение энтропии при стандартных условиях для реакции
4NH3 + 3O2 = 6H2Oж + 2N2.
6. Какой знак будет иметь D S  для реакции Н2, г + S к = Н2S г? Вывод сопоставьте с результатами расчетов.
для реакции Н2, г + S к = Н2S г? Вывод сопоставьте с результатами расчетов.
7. Определите знак D S  реакции и укажите направление протекания реакции в изолированной системе NH4NO3, г = N2 + 2H2Oг +
реакции и укажите направление протекания реакции в изолированной системе NH4NO3, г = N2 + 2H2Oг +  О2.
О2.
8. Какой знак будет иметь D S  для реакции 2Н2 + О2 = 2Н2Ог? Сопоставьте вывод с результатами расчетов.
для реакции 2Н2 + О2 = 2Н2Ог? Сопоставьте вывод с результатами расчетов.
9. Какой знак будет иметь D S  для реакции 2СН4 = С2Н2 + 3Н2? Сопоставьте вывод с результатами расчетов.
для реакции 2СН4 = С2Н2 + 3Н2? Сопоставьте вывод с результатами расчетов.
10. Укажите знак изменения энтропии при конденсации воды.
11. Качественно сравните между собой S  следующих веществ: Sк , Sг, S2, г. Ответ поясните.
следующих веществ: Sк , Sг, S2, г. Ответ поясните.
12. Для йода в различных агрегатных состояниях значения S  равны 116; 261 и 137
равны 116; 261 и 137  . Определите агрегатное состояние йода в каждом случае.
. Определите агрегатное состояние йода в каждом случае.
13. Для воды в различных агрегатных состояниях значения S  равны 69,95; 39,33 и 188,72
равны 69,95; 39,33 и 188,72  . Определите агрегатное состояние воды в каждом случае.
. Определите агрегатное состояние воды в каждом случае.
14. Значения S  красного, белого и черного фосфора соответственно равны 22,8; 41,1 и 22,7
красного, белого и черного фосфора соответственно равны 22,8; 41,1 и 22,7  . Укажите какие полиморфные превращения претерпевает фосфор в твердом виде при нагревании.
. Укажите какие полиморфные превращения претерпевает фосфор в твердом виде при нагревании.
15. Значения S  красного и желтого PbO соответственно равны 66,11 и 68,70
красного и желтого PbO соответственно равны 66,11 и 68,70  . Укажите, какая модификация оксида свинца обладает более упорядоченной кристаллической решеткой. Ответ объясните.
. Укажите, какая модификация оксида свинца обладает более упорядоченной кристаллической решеткой. Ответ объясните.
16. Какой знак будет иметь D S  для реакции 2Сграфит + О2 = 2СОг? Сопоставьте вывод с результатами расчетов.
для реакции 2Сграфит + О2 = 2СОг? Сопоставьте вывод с результатами расчетов.
17. Какой знак будет иметь D S  для реакции 2Н2Ог + Сграфит = 2Н2 + СО2? Сопоставьте вывод с результатами расчетов.
для реакции 2Н2Ог + Сграфит = 2Н2 + СО2? Сопоставьте вывод с результатами расчетов.
18. Укажите знак изменения энтропии при синтезе аммиака из N2 и H2.
19. Известно две аллотропических модификации TiO2 - рутил и анатаз. Значение S  рутила и анатаза соответственно равно 50,33 и 49,92
рутила и анатаза соответственно равно 50,33 и 49,92 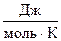 . Определите в каком состоянии оксид титана (IV) имеет более неупорядоченную структуру.
. Определите в каком состоянии оксид титана (IV) имеет более неупорядоченную структуру.
20. Какой знак будет иметь D S  для реакции N2, г + О2, г = 2NOг? Сопоставьте вывод с результатами расчетов, если S
для реакции N2, г + О2, г = 2NOг? Сопоставьте вывод с результатами расчетов, если S  участников реакции равны: N2 - 191,5; O2 - 205,0; NO - 210,6
участников реакции равны: N2 - 191,5; O2 - 205,0; NO - 210,6  .
.
21. Вычислите D S  процесса конденсации йода.
процесса конденсации йода.
22. Вычислите D S  при переходе красного фосфора в белый.
при переходе красного фосфора в белый.
23. Вычислите D S  реакции разложения 0,5 кг нитрата аммония на простые вещества.
реакции разложения 0,5 кг нитрата аммония на простые вещества.
24. Определите D S  реакции окисления кристаллического железа газообразным кислородом с образованием оксида железа (III).
реакции окисления кристаллического железа газообразным кислородом с образованием оксида железа (III).
25. Какой знак будет иметь D S  для реакции 2SO2 + О2 = 2SО3? Сопоставьте вывод с результатами расчетов.
для реакции 2SO2 + О2 = 2SО3? Сопоставьте вывод с результатами расчетов.