Как показало изучение свойств белков в растворах, макромолекулы белков имеют форму компактных шаров (глобул) или вытянутых структур – фибрилл. Исследования показали, что в укладке пептидной цепи нет ничего случайного или хаотичного. Она свертывается упорядоченно, для каждого белка определенным образом. Полярные боковые группы аминокислот стремятся расположиться на поверхности глобулы, где могут взаимодействовать с водой, а неполярные группы располагаются внутри.
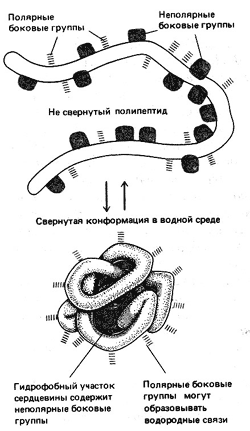
Образование глобулы
Для того, чтобы разобраться в замысловатой укладке (архитектонике) белковой макромолекулы, следует рассмотреть в ней несколько уровней организации.
Первичной структурой белка называется полная последовательность аминокислотных остатков в полипептидной цепи.
Она определяется генотипом, т.е. генами организма. В первичной структуре все связи между аминокислотными остатками являются ковалентными и, следовательно, прочными. Разные белки отличаются друг от друга по первичной структуре: кератин имеет одну последовательность аминокислот, пепсин – другую, соматотропин (гормон роста) – третью и т.д. В первичной структуре белка можно различить N-конец цепочки, содержащий свободную NH2-группу, и С-конец, содержащий свободную СООН-группу.
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером в 1944–1954 гг. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (из 21 и 30 аминокислотных остатков), удерживаемых друг около друга дисульфидными мостиками.
Однако молекула белка в виде цепи аминокислот, последовательно соединенных пептидными связями, еще не способна выполнять специфические функции. Для этого необходим более высокий уровень структурной организации, выражающийся в усложнении пространственного расположения мономеров.
Вторичная структура белка представлена спиралью, в которую закручивается полипептидная цепь. Группы N–H и С=О, входящие в пептидную связь, заметно поляризованы: азот обладает большей электроотрицательностью, чем водород, а кислород – большей, чем углерод.
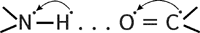
Кислород группы С=О может образовывать водородные связи с водородом группы N–H (разумеется, расположенной в другой пептидной связи).
Одной из разновидностей вторичной структуры является  - спираль, где каждый атом кислорода связан с атомом водорода четвертой по ходу спирали NH-группы.
- спираль, где каждый атом кислорода связан с атомом водорода четвертой по ходу спирали NH-группы.

 -спираль
-спираль
Альтернативная вторичная структура  -слой (или складчатый слой) имеет водородную связь между звеньями соседних полипептидных цепей.
-слой (или складчатый слой) имеет водородную связь между звеньями соседних полипептидных цепей.

 -слой
-слой
Третичная структура белка представляет собой сложную трехмерную пространственную упаковку
 -спиралей и
-спиралей и  -слоев. Эта трехмерная структура устанавливается за счет взаимодействия радикалов аминокислот, между которыми могут возникнуть связи несколько типов:
-слоев. Эта трехмерная структура устанавливается за счет взаимодействия радикалов аминокислот, между которыми могут возникнуть связи несколько типов:
1) ионные, возникающие за счет электростатического взаимодействия между отрицательно и положительно заряженными боковыми группами;
2) гидрофобные («не любящие воду»), устанавливающиеся за счет стремления неполярных радикалов объединяться друг с другом, а не смешиваться с окружающей их водной средой;
3) дисульфидные, которые образуются между атомами серы SH-групп двух остатков аминокислоты цистеина. Эти S–S связи по своей природе являются ковалентными;
4) водородные, которые также возникают за счет взаимодействия между атомами радикалов.
Третичная структура белка не является конечной. Для некоторых белков, чаще всего регуляторных, характерна четвертичная структура, необходимая им для эффективного выполнения функции.
Четвертичная структура представлена ассоциантом, состоящим из нескольких полипептидных цепей. Например, сложная молекула гемоглобина состоит из двух  -субъединиц (141 аминокислотный остаток) и двух
-субъединиц (141 аминокислотный остаток) и двух  -субъединиц (146 аминокислотных остатков). Каждая субъединица связана с молекулой железосодержащего гема. В результате их объединения образуется функционирующая молекула гемоглобина. Только в такой упаковке гемоглобин работает полноценно, то есть способен переносить кислород. Четвертичная структура стабилизируется теми же связями, что и третичная.
-субъединиц (146 аминокислотных остатков). Каждая субъединица связана с молекулой железосодержащего гема. В результате их объединения образуется функционирующая молекула гемоглобина. Только в такой упаковке гемоглобин работает полноценно, то есть способен переносить кислород. Четвертичная структура стабилизируется теми же связями, что и третичная.
Пространственная конфигурация белка т.е. третичная и четвертичная структуры называется конформацией. Конформация белка определяется его первичной структурой: белковая цепочка с определенной последовательностью аминокислот самопроизвольно укладывается с образованием природной пространственной конфигурации. Это получило название «самосборка белковой молекулы». Если полипептидную цепь взять за концы, растянуть ее и затем отпустить, то она всякий раз будет свертываться в одну и ту же структуру, характерную для этого вида полипептида.
В то же время из сказанного, очевидно, следует, что, изменив всего лишь одну аминокислоту в каком-либо полипептиде, мы получим молекулу с совершенно иной структурой, а значит и с иными свойствами.
Классификация белков
Сложность строения белковых молекул и чрезвычайное разнообразие их функций крайне затрудняет создание единой четкой классификации белков на какой-либо одной основе. Поэтому рассмотрим несколько классификаций белков.
1. Классификация белков по составу.
Простые белки (протеины) – состоят только из аминокислот (альбумины, глобулины, гистоны, склеропротеины).
Сложные белки (протеиды) – состоят из глобулярных белков и небелкового материала. Небелковую часть называют простетической группой (фосфопротеиды, гликопротеиды, нуклеопротеиды, хромопротеиды, липопротеиды, металлопротеиды, флавопротеиды).
2. Классификация белков по их структуре.
Фибриллярные – образуют длинные волокна или слоистые структуры (коллаген, миозин, фиброин, кератин). Они нерастворимы в воде.
Глобулярные – их полипептидные цепи свернуты в компактные глобулы (ферменты, антитела, гормон инсулин).
Промежуточные – фибриллярной природы, но растворяются в воде (фибриноген).
3. Классификация белков по функциям.
Структурные – входят в различные структуры клетки и организма.
Ферменты – являются биологическими катализаторами.
Гормоны – являются регуляторами биологических функций.
Транспортные – переносят различные вещества.
Защитные – обеспечивают иммунные реакции организма.
Сократительные – участвуют в сокращении мышечных волокон.
Запасные – служат резервными веществами клетки и организма.
Токсины – являются ядами, используемыми живыми существами в целях защиты или нападения.
Таким образом, подходы к классификации белков могут быть различными.
Таблица. Уровни организации белков
| Уровень организации | Признаки | Связи, участвующие в образовании структуры |
| Первичная | Линейная последовательность аминокислот в полипептидной цепи | Ковалентные (пептидные) связи между остатком карбоксильной группы одной аминокислоты и остатком аминогруппы другой аминокислоты |
| Вторичная |  -спираль, -спираль,  -структура или спирали с параметрами, отличными от -структура или спирали с параметрами, отличными от  -спиралей -спиралей
| Водородные связи между остатками карбоксильной группы одной аминокислоты и остатком аминогруппы другой, удаленной от первой на четыре аминокислотных остатка; в  -структуре водородные связи между остатками карбоксильных и аминогрупп одной цепи и остатками одноименных групп другой цепи; в спиралях – аналогично -структуре водородные связи между остатками карбоксильных и аминогрупп одной цепи и остатками одноименных групп другой цепи; в спиралях – аналогично  -спиралям, но расстояние между витками иное -спиралям, но расстояние между витками иное
|
| Третичная | Глобула, образующаяся в результате компактной укладки  -спирали; -спирали;  -структуры, уложенные параллельными слоями; суперспираль – несколько спиралей, скрученных вместе -структуры, уложенные параллельными слоями; суперспираль – несколько спиралей, скрученных вместе
| Ионные, дисульфидные мостики, гидрофобные, водородные |
| Четвертичная | Агрегат из нескольких глобул. Свойственна лишь белкам с особо сложной структурой | В основном силы межмолекулярного притяжения, в меньшей степени – водородные, ионные и ковалентные |