Явление ядерного магнитного резонанса (ЯМР), открытое в 1945 г. Ф. Блохом и Э. Перселлом, ныне лауреатами Нобелевской премии, легло в основу создания нового вида спектроскопии, который в очень короткий срок превратился в один из самых информативных методов исследования молекулярной структуры и динамики молекул, межмолекулярных взаимодействий, механизмов химических реакций и количественного анализа веществ в различных агрегатных состояниях. Возможность идентификации всех без исключения линий спектра позволяет идентифицировать промежуточные продукты химических реакций (ионы, радикалы, ион-радикалы и др.), в том числе относительно короткоживущие, образование которых в ходе химических процессов ранее лишь постулировалось. Нередко оказывается возможным исследовать кинетику и механизмы химических реакций по расходованию и накоплению начальных, промежуточных и конечных продуктов.
Уникальная специфика метода ЯМР заключается в возможности изучения кинетики и механизмов равновесных химических превращений – так называемых обменных процессов (обмен атомов, электронов, групп атомов, конформационные превращения, валентная изомеризация и др.), в том числе между идентичными молекулами (вырожденный обмен). Применение специальных методов (мультиплетные резонансы, двухмерная спектроскопия) позволяет однозначно устанавливать механизмы таких процессов.
ЯМР-спектроскопию с успехом используют для исследования межмолекулярных взаимодействий – водородных связей, комплексообразования, структуры жидкокристаллических и мицеллярных систем.
Первые успехи использования метода в органической химии связаны с развитием ЯМР-спектроскопии 1Н, поскольку ядра атомов водорода (протоны) входят в состав большинства органических соединений, имеют высокое (99,98%) естественное содержание и, кроме того, их сигналы наиболее интенсивны по сравнению с сигналами других магнитных ядер. 80-е гг. характеризуются широким практическим применением ЯМР-спектроскопии главного элемента органической химии - углерода (13С), а также развитием резонансной спектроскопии таких важных для органической химии ядер, как 15N и 17О. Дальнейшее развитие ЯМР-спектроскопии определяется, в первую очередь, внедрением в повседневную практику импульсных Фурье ЯМР-спектрометров с резонансными частотами 300 МГц и более (для протонов), совершенствованием и без того многообразных импульсных методик и на этой основе – широким развитием ЯМР-спектроскопии «редких» ядер, формированием теории и методов исследования быстрых необратимых реакций, использованием данных по определению времен релаксации, эволюцией спектроскопии высокого разрешения в твердом теле и другими техническими усовершенствованиями, многие из которых в настоящее время даже трудно себе представить (см. табл).
|
|
| Массовое число | Нечетное | Четное | Четное |
| Атомное число (порядковый номер элемента) | Четное или нечетное | Четное | Нечетное |
| Результирующий ядерный спин I | ½, 3/2, 5/2 | 1, 2, 3 | |
| Пример | 1H, 13С – ½ 11B, 35Cl, 37Cl, 79Br, 81Br 17O, 127I | 12С, 16О, 32S | 2H, 10B, 16O, 14N, 30P |
В последние годы, особенно благодаря усовершенствованию используемого оборудования, повышению его быстродействия и разрешающей способности, возрос интерес к ЯМР-спектроскории не только как к методу исследования, но и как к одному из очень перспективных методов контроля качества разнообразной продукции. В соответствии с этим быстро расширяется круг специалистов, активно стремящихся овладеть этим методом.
|
|
Основные характеристики атомного ядра. Связь механического и магнитного моментов ядра. Поведение магнитного момента ядра в магнитном поле, основное уравнение ЯМР.
Атомное ядро – это центральная часть атома, в которой сосредоточен весь положительный заряд и почти вся масса.
Основными характеристиками атомного ядра являются заряд, масса, спин и магнитный момент.
Заряд ядраопределяется количеством протонов (z), входящих в состав ядра. Заряд ядра (zq) для разных химических элементов различен. Число z называют атомным номером или зарядовым числом. Атомный номер является порядковым номером химического элемента в периодической системе элементов Д.Менделеева. Заряд ядра определяет и количество электронов в атоме. От количества электронов атома зависит их распределение по энергетическим оболочкам и подоболочкам и, следовательно, все физико-химические свойства атома. Заряд ядра определяет специфику данного химического элемента.
Масса ядраМасса ядра определяется количеством (А) нуклонов, которые входят в состав ядра. Число нуклонов в ядре (А) называется массовым числом. Число нейтронов (N) в ядре можно найти если от общего числа нуклонов (А) отнять число протонов (z), т.е N=F-z. В периодической таблице до ее середины количество протонов и нейтронов в ядрах атомов примерно одинаково, т.е. (А-z)/z= 1, к концу таблицы (А-z)/z= 1,6.
|
|
Ядра атомов принято обозначать так:
X - символ химического элемента;Z – атомный номер;A – массовое число.
Массы нуклонов, ядер атомов, атомов, электронов и других частиц в ядерной физике принято измерять не в «КГ», в атомных единицах массы (а.е.м. – иначе называют углеродной единицей массы и обозначают «е»). За атомную единицу массы (1е) принята 1/12 массы атома углерода 1е=1,6603 ∙ 10-27кг.
Электрон в атоме движется вокруг ядра. В классической физике движению точки по окружности соответствует момент импульса L=mvr, где m – масса частицы, v – её скорость, r – радиус траектории. В квантовой механике эта формула неприменима, так как неопределенны одновременно радиус и скорость. Но сама величина момента импульса существует. Из квантово-механической теории атома водорода следует, что модуль момента импульса электрона может принимать следующие дискретные значения:

| (40) |
где l – так называемое орбитальное квантовое число, l = 0, 1, 2, … n - 1. Таким образом, момент импульса электрона, как и энергия, квантуется, т.е. принимает дискретные значения. Заметим, что при больших значениях квантового числа l (l >> 1) примет вид:

Это не что иное, как один из постулатов Н. Бора.
Из квантово-механической теории атома водорода следует еще один важный вывод: проекция момента импульса электрона на какое-либо заданное направление впространстве z (например, на направление силовых линий магнитного или электрического поля) также квантуется по правилу:

| (41) |
где m = 0, ± 1, ± 2, …± l – так называемое магнитное квантовое число.
Электрон, движущийся вокруг ядра, представляет собой элементарный круговой электрический ток. Такому току соответствует магнитный момент pm. Очевидно, что он пропорционален механическому моменту импульса L. Отношение магнитного момента p m электрона к механическому моменту импульса L называется гиромагнитным отношением. Для электрона в атоме водорода

| (42) |
(знак минус показывает, что вектора магнитного и механического моментов направлены в противоположные стороны). Отсюда можно найти так называемый орбитальный магнитный момент электрона:

| (43) |
Эта величина,как видим, также квантуется.
В формуле (43) величина  является константой. Обозначим её mв и назовем магнетоном Бора. Магнетон Бора служит естественной единицей магнитного момента электрона, так как значения магнитного момента кратны величине mв:
является константой. Обозначим её mв и назовем магнетоном Бора. Магнетон Бора служит естественной единицей магнитного момента электрона, так как значения магнитного момента кратны величине mв:
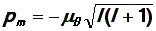
|
В чем состоит явление ЯМР? Если наблюдать движение волчка в поле тяжести Земли, то под влиянием этого поля ось волчка совершает вращение вокруг направления поля тяжести. Такое движение называют прецессией. Частота этого вращения зависит от величины поля тяжести, т.е. если представить себе, что это вращение происходит не на Земле, а на Луне, то частота прецессии будет в шесть раз меньше, чем на Земле. Подобное наблюдается и для магнитного диполя, например, для атомного ядра со спином I, магнитным моментом 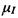 и гиромагнитным отношением
и гиромагнитным отношением  , помещенного в магнитное полеВо, вектор
, помещенного в магнитное полеВо, вектор  совершает прецессию с угловой частотой
совершает прецессию с угловой частотой  . Эта частота тем больше, чем больше гиромагнитное отношение yiи внешнее магнитное поле Во, а именно:
. Эта частота тем больше, чем больше гиромагнитное отношение yiи внешнее магнитное поле Во, а именно:  .
.
Если же на ядерный спин I кроме статического магнитного поля Во воздействует еще и переменное магнитное поле Bi, перпендикулярное полю Во, то в системе может наступить резонанс. Это происходит в случае, когда частота  этого переменного поля равна частоте прецессии
этого переменного поля равна частоте прецессии  магнитных моментов ядер. В результате наблюдаем в системе очень сильное взаимодействие, даже если переменное поле В/ мало.
магнитных моментов ядер. В результате наблюдаем в системе очень сильное взаимодействие, даже если переменное поле В/ мало.
Резонансный эффект - явление, широко распространенное в окружающем мире. Например, маятник можно раскачать до очень большой амплитуды, если оказывать воздействие на него в определенной точке "фазы качания".
Простая математическая формула 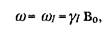
выражающая условие резонанса, является основным уравнением ЯМР.