Прохождение тока через растворы

Рис. 75. Механизм прохождения тока через раствор
По современным воззрениям, электрический ток в металлических проводниках — это поток электронов, передвигающихся от отрицательного полюса источника тока к положительному полюсу.
Источник тока, например гальванический элемент, представляет собой прибор, в котором на отрицательном полюсе накапливается больше электронов, чем на положительном, отчего на первом создается как бы некоторое давление электронов. Если соединить полюсы элемента металлической проволокой, то под влиянием этого давления электроны начинают передвигаться по проволоке от отрицательного полюса к положительному так же, как газ переходит от места, где давление больше, туда, где давление меньше. Убыль электронов у отрицательного полюса сейчас же пополняется за счет источника тока, вследствие чего происходит непрерывная циркуляция электронов в проводнике, соединяющем полюсы. Источник тока действует подобно насосу, который засасывает электроны через положительный полюс и снова выталкивает их в проводник через отрицательный полюс.
Если разрезать проволоку, то один конец ее зарядится отрицательно, так как на нем накопится избыток электронов, а другой, вследствие недостатка электронов, зарядится положительно; на этом движение электронов по проволоке прекратится.
Положим теперь, что в раствор электролита, например соляной кислоты, опущены два электрода, соединенные с полюсами источника тока, и следовательно, заряженные один положительно, другой — отрицательно. Вода сама по себе не проводник, и электроны не могут перемещаться в ней, как в проволоке, но находящиеся в растворе ионы, притягиваясь к электродам, тотчас же начинают передвигаться по двум противоположным направлениям: положительные ионы двигаются к катоду, отрицательные— к аноду (рис. 75). Достигая катода, положительные ионы получают от него недостающие им электроны и становятся нейтральными атомами. Одновременно с этим отрицательные ионы отдают аноду свои «лишние» электроны, тоже переходя в нейтральные атомы или остатки молекул. Благодаря непрерывному переходу электронов с катода на ионы и с ионов на анод поддерживается движение электронов в проводах, соединяющих полюсы элемента с электродами. В самом же растворе движутся не электроны, а положительно и отрицательно заряженные ионы. Последние как бы переносят электроны через раствор от катода к аноду, хотя в действительности анионы отдают аноду не те электроны, которые перешли из катода в раствор, а свои собственные.
Из сказанного ясно, что растворы, не содержащие ионов, не могут проводить электрический ток.
Движение ионов при прохождении тока через раствор может быть обнаружено прямым опытом. Для такого опыта особенно пригодны соли, ионы которых окрашены. Возьмем, например, синий раствор медного купороса. Окраска этого раствора не может быть приписана наличию в нем ионов SO4», так как многие растворы, содержащие эти ионы, бесцветны (например, растворы H2SO4, Na2SO4, ZnSO4 и др.). Разбавленные же растворы медных солей имеют синий цвет, из чего приходится заключить, что синяя окраска зависит от присутствия ионов меди (точнее—их гидратов).
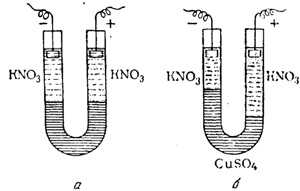
Рис. 76. Трубки с раствором медного купороса: а — до пропускания электрического тока; б — после пропускания электрического тока.
Чтобы наблюдать движение этих ионов, в U-образную трубку (рис. 76) наливают раствор медного купороса в теплой воде, содержащий немного агар-агара (органическое вещество, получаемое из морских водорослей). По охлаждении раствор превращается в студень, не препятствующий сколько-нибудь заметно движению ионов. Поверх этого студня в оба колена трубки наливают бесцветный раствор какой-нибудь соли, например KNO3, к которому тоже прибавлен агар-агар. При пропускании тока синие ионы меди направляются к отрицательному электроду и постепенно окрашивают бесцветный слой агар-агара в левом колене трубки снизу вверх в синий цвет. В то же время в правом колене трубки граница между синим и бесцветным растворами опускается.
Перемещение ионов происходит с различной скоростью, зависящей, кроме природы ионов, также от температуры, и от напряжения тока. Чем выше температура и чем больше напряжение тока, тем быстрее движутся ионы. Наибольшей скоростью движения обладают ионы водорода,_но все же и они перемещаются очень медленно, всего лишь на 0,2 см в минуту при температуре 18° и падении напряжения в 1 вольт на 1 см. Скорости некоторых других ионов при тех же условиях выражаются следующими цифрами: ОН’ — 0,111 см/мин, Na• — 0,027 см/мин, Сl’— 0,0415 см/мин, NO3‘ —0,039 см/мин