ОГЛАВЛЕНИЕ
ОГЛАВЛЕНИЕ.......................................................................................................................... 2
СЕРЕБРО Ag.............................................................................................................................. 3
ИСТОРИЧЕСКАЯ СПРАВКА................................................................................................. 3
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ.............................................................................. 4
ПЕРЕРАБОТКА СЕРЕБРЯНЫХ РУД И ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО СЕРЕБРА 5
РАФИНИРОВАНИЕ СЕРЕБРА............................................................................................ 10
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА................................................................ 10
ПРИМЕНЕНИЕ....................................................................................................................... 14
СОЕДИНЕНИЯ (ОБЩИЕ СВОЙСТВА).............................................................................. 15
Соединения одновалентного серебра................................................................................ 15
Неорганические соединения.............................................................................................. 16
Координационные соединения.......................................................................................... 22
Соединения двухвалентного серебра............................................................. 22
Неорганические соединения.............................................................................................. 23
Координационные соединения.......................................................................................... 24
Соединения трехвалентного серебра.............................................................. 24
СПИСОК ЛИТЕРАТУРЫ....................................................................................................... 26
СЕРЕБРО Ag
| Базовые характеристики | ||
| Порядковый номер | ||
| Атомный вес | 107,870 у.е. | |
| Валентность | I, (II), (III) | |
| Заряд | 1+, (2+), (3+) | |
| Массовые числа природных изотопов | 107, 109 | |
| Электронная структура атома меди | К L-М 4s24p64d105s1 | |
| Электронная структура атома меди и катиона Ag+ для 4d и 5s-орбиталей | 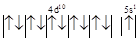 Ag
Ag
|  Ag+
Ag+
|
ИСТОРИЧЕСКАЯ СПРАВКА
Серебро является одним из тех металлов, которые привлекли внимание человека еще в древние времена. История серебра тесно связана с алхимией, поскольку уже в те времена был разработан метод купелирования серебра.
За 2500 лет до н. э. в Древнем Египте носили украшения и чеканили монеты из серебра, считая, что оно дороже золота. В X в. было показано, что между серебром и медью существом аналогия, и медь рассматривалась как серебро, окрашенное в красный цвет. В 1250 г. Винсент Бове высказал предположи что серебро образуется из ртути при действии серы.
В средние века кобалдом называли руды, которые служили для получения металла со свойствами, отличными от уже известного серебра. Позднее было показано, что из этих минералов добывается сплав серебро — кобальт, и различие в свойствах определялось присутствием кобальта. В XVI в. Парацельс получил хлорид серебра из элементов а Бойль определил его состав. Шееле изучал действие света на хлорид серебра, а открытие фотографии привлекло внимание и кдругим галогенидам серебра. В 1663 г. Глазер предложил нитрат серебра в качестве прижигающего средства. С конца XIX в. комплексные цианиды серебра используются в гальванопластике.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Серебро является редким металлом, его содержание в земной коре равно 1·10-5 вес.%. В природе серебро встречается как самородное, так и в виде соединений — сульфидов, селенатов, теллуратов или галогенидов в различных минералах.
Серебро встречается также в метеоритах и содержится в морской воде.
Серебро в виде самородков встречается в природе реже, чем самородная медь или золото, и часто это бывают сплавы с золотом, медью (медьсодержащее серебро), сурьмой (сурьмусодержащие серебро), ртутью и платиной. Образование самородного серебра связано с действием воды или водорода на сульфид серебра (соответственно на аргентит). Металлическое серебро представляет собой гранецентрированные кубические кристаллы серебристо-белого цвета, часто покрыты черным налетом. Залежи самородного серебра находятся в России, Норвегии, Канаде, Чили, ФРГ и других странах. Наиболее важными минералами серебра являются следующие:
- Кантпит, (Ag2S), серые ромбические кристаллы, устойчивые при температуре ниже +179°С. Обе модификации природного сульфида серебра содержат 87,1% Ag, имеют плотность 7,2—7,4 г/см3 и твердость 2—2,5 единицы по шкале Мооса.
- Аргентит, (Ag2S), серые кубические кристаллы, устойчивые при температуре выше +179°С. Аргентит — основной источник серебра. В природе он сопутствует самородному серебру, кераргиту (AgCl), церусситу (РbС03), арсенидам и антимонидам серебра; его залежи часто находятся рядом с сульфидами свинца, цинка и меди.Такие руды находятся в Норвегии, Мексике, Перу, СССР, Чили.
- Галенит (AgS), добываемый в Румынии, Франции, содержит серебро.
- Прустит (Ag3AsS3 или 3Ag2S -As2S3), содержит 65,4% серебра.
- Пираргерит (Ag3SbS3 или 3Ag2S -Sb2S3), содержит 68,4% серебра.
- Стефанит (8(Ag, Cu)2S-Sb2S3), содержит 62,1—74,9% Ag
- Кераргирит (AgCl), содержит 75,3% серебра.
При окислении аргентита (акантита) Ag2S образуется сульфат серебра Ag2SO4, который будучи частично растворим, вымывается водой. Когда на пути вод, одержащих сульфат серебра, встречается сульфат железа(II), выделяется свободное серебро, а если встречаются хлориды (т.е. ионы Сl-), то образуется кераргирит:
Ag2SO4 + 2FeSO4 - 2Ag + Fe2(SO4)3
Ag2SO4 + 2NaCl = 2AgCl + Na2SO4
Если воды, содержащие сульфид серебра, встречают сульфиды других элементов, то образуются скопления двойных сульфидов подобно встречающимся смесям серебро - мышьяк, серебро - сурьма, серебро - медь, серебро - свинец, серебро - германий.