Класс
Химия.
- Вещество – это то, из чего состоят физические тела.
- Химия – это наука о веществах, их свойствах и превращениях.
Определенный вид атомов называется химическим элементом.
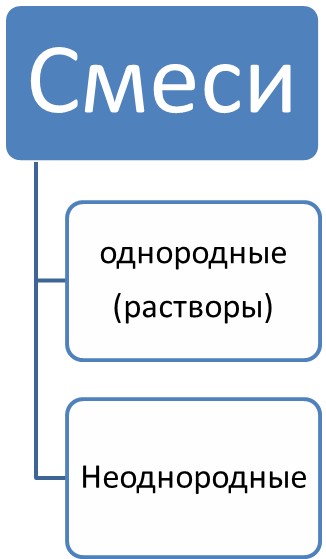
2.Чистые вещества и смеси.
Смеси- Комбинация из нескольких веществ.
Способы разделения смесей.
Однородные смеси
А)Выпаривание В)Дистилляция(перегонка
Б)Кристализация Г)Хромотография
Неоднородные смеси
А)Отстаивание В)Действие магнитом
Б)Фильтрование Г)Кипячение
Физичесике и химические явления.
Физические явления -это явления,в результате которого изменяется форма и агрегатное состояние вещества,а состав не изменяется.
Химическое явление -это явление,в результате которого происходит образование нового вещества(химические реакции).
Вазгонка -процесс перехода из твёрдого агрегатного состояния в газообразное,минуя жидкое состояние.
Обратный процесс называется-Сублимация.
Признак химической реакции:
1. Выделение газа
2. Образование осадка
3. Выделение или поглащение теплоты(Q+,Q-)
4. Изменение окраски
5. Излучение света
6. Появление запаха
Атомы и Молекулы.
Лет назад Демокрит высказал мысль о том,что все тела в природе состоят из мельчайших невидимых частиц.
М.В.Ломоносов(18в) утверждал,что все тела состоят из корпускул-молекул,в состав которых входят элементы-атомы.
Знаки химических элементов.
До 17 века были известны только 10 химических элементов.
Золото(Au), Серебро(Ag), Медь(Cu), Свинец(Pb), Железо(Fe), Олово(Sn), Платина(Pt), Ртуть(Hg), Углерод(С), Сурьма(Sb), Кислород(О).
Углерод-Carbonium-C «це»
Водород-Hydrogenium-H «аш»
Медь-Cuprum-Cu «купрум»
Кальций-Calcium-Ca «кальций»
Химический элемент-это определённый вид атома.
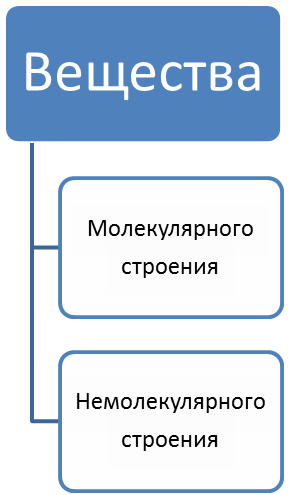
Вещества.
Вещества:
Простые(С,Pb,Сu,Ca)
Сложные(HCl,H2O,Na3PO4)
C-химический элемент Fe-химический элемент
С-Простое вещество Fe-простое вещество
Закон постоянства состава вещества
Каждое вещество с молекулярным строением не зависимо от способа его получения имеет один и тот же постоянный качественый и количественый состав.
C+O2=CO2
CH4+O2=CO2+H2O
Качественный состав вещества указывает на виды атомов.
Количественный состав указывает на количество данных атомов.
Относительная атомная масса.
Ar –показывает во сколько раз масса данного атома больше одной двенадцатой 
Массы углерода.
Ar(H)=1 m(H)=1 a.е.м.
Ar(С)=12 m(C)=12a.е.м.
Относительная молекулярная масса.
Mr-показывает во сколько раз масса молекулы больше  массы атома углерода
массы атома углерода
n*Ar(1)+n*Ar(2)
Mr(CO2)=1*12+2*16=12+32=44
M-молекулярная масса
М(Н2О)=18 а.е.м.
Mr(H2SO4)=2*1+1*32+4*16=98
M(H2SO4)=98 а.е.м.
Н2О H2SO4
Отношение атомов
Отношение масс
Отношение масс
Массовая доля химических элементов в веществах.
W-массовая доля
M(H2SO4)=98 а.е.м.
m(H):m(S):m(O)=2:32:64
w(H)= 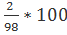 =2.04%
=2.04%
w(S)= 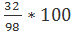 =32.65%
=32.65%
w(O)=  =65.31%
=65.31%
Массовая доля химического элемента в сложном веществе равна отношению его масс в молекуле к молекулярной массе данного вещества.
Валентность.
Валентность-способность атомов присоединять к себе определёное число других атомов,это число химических связей.
Правило определения валентности химического элемента в соединениях:
H-1
О-2
высшая валентность химического элемента совпадает с номером группы в ПСХЭ.