Хром
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии:
+24Cr 1s22s 2 2p 6 3s 2 3p 6 3d 5 4s 1 1s 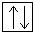 2s
2s  2p
2p 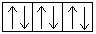
3s  3p
3p  4s
4s 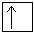 3d
3d 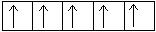
Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.

Температура плавления 1890оС, температура кипения 2680оС, плотность хрома 7,19 г/см3.
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия): 2Al + Cr2O3 → 2Cr + Al2O3
Качественные реакции
 Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами. При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами. При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Например, хлорид хрома (II) взаимодействует с гидроксидом натрия:
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
 Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами. При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами. При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Например, хлорид хрома (III) взаимодействует с гидроксидом калия:
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Cr(OH)3 + 3KOH → K3[Cr(OH)6]
Обратите внимание, если мы поместим соль хрома (III) в избыток раствора щелочи, то осадок гидроксида хрома (III) не образуется, т.к. в избытке щелочи соединения хрома (III) сразу переходят в комплекс:
CrCl3 + 6KOH → K3[Cr(OH)6] + 3KCl
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2+ 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr2++ 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4+
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (III).
CrCl3+ 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr3++ 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4+
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
2Cr + 3S → Cr2S3
1.3. Хром взаимодействует с фосфором. При этом образуется бинарное соединение – фосфид хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000оС с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
4Cr + 3O2 → 2Cr2O3
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2Cr + 3H2O(пар) → Cr2O3 + 3H2
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Например, хром бурно реагирует с соляной кислотой:
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода: 2Cr + 6H2SO4 → Cr2(SO4)3 + 3SO2 + 6H2O
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром: Cr + 6HNO3 → Cr(NO3)3 + 3NO2 + 3H2O
2.5. Растворы щелочей на хром практически не действуют.
2.6. Однако хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей.
Например, хром реагирует с хлоридом меди с образованием хлорида хрома (III) и меди: 2Cr + 3CuCl2→ 2CrCl3+ 3Cu
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Например, при сплавлении хрома с хлоратом калия в щелочи хром окисляется до хромата калия:
Cr + KClO3 + 2KOH → K2CrO4 + KCl + H2O
Хлорат калия и нитрат калия также окисляют хром:
2Cr + KClO3 → Cr2O3 + KCl
2Cr + 3KNO3 → Cr2O3 + 3KNO2
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами:
1. Термическим разложением гидроксида хрома (III):
2Cr(OH)3→ Cr2O3 + 3H2O
2. Разложением дихромата аммония:
(NH4)2C2O7 → Cr2O3 + N2 + 4H2O
3. Восстановлением дихромата калия углеродом (коксом) или серой:
2K2Cr2O7 + 3C → 2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S → Cr2O3 + K2SO4
Химические свойства
Оксид хрома (III) – типичный амфотерный оксид. При этом оксид химически довольно инертен. В высокодисперсном состоянии с трудом взаимодействует с кислотами и щелочами.
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
Например, оксид хрома (III) взаимодействует с оксидом натрия:
Na2O + Cr2O3 → 2NaCrO2
2. Оксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли — хромиты, а в растворе реакция практически не идет. При этом оксид хрома (III) проявляет кислотные свойства.
Например, оксид хрома (III) взаимодействует с гидроксидом натрия в расплаве с образованием хромита натрия и воды:
2NaOH + Cr2O3 → 2NaCrO2 + H2O
3. Оксид хрома (III) не взаимодействует с водой.
4. Оксид хрома (III) проявляет слабые восстановительные свойства. В щелочных расплавах окислителей окисляется до соединений хрома (VI).
Например, оксид хрома (III) взаимодействует с нитратом калия в щелочной среде:
Cr2O3 + 3KNO3 + 4KOH → 2K2CrO4 + 3KNO2+ 2H2O
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Cr2O3 + 3Br2 + 10NaOH → 2Na2CrO4 + 6NaBr + 5H2O
Озоном или кислородом:
Сr2O3 + O3 + 4KOH → 2K2CrO4 + 2H2O
Cr2O3 + 3O2+ 4Na2CO3 → 2Na2CrO4 + 4CO2
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III): Сr2O3 + 3NaNO3 + 2Na2CO3 → 2Na2CrO4 + 2CO2 + 3NaNO2
Cr2O3 + KClO3 + 2Na2CO3 → 2Na2CrO4 + KCl + 2CO2
5. Оксид хрома (III) в высокодисперсном состоянии при сильном нагревании взаимодействует с сильными кислотами.
Например, оксид хрома (III) реагирует с серной кислотой:
Cr2O3 + 3H2SO4 → Cr2(SO4)3 + 3H2O
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Например, оксид хрома (III) реагирует с алюминием (термит):
2Al + Cr2O3 → Al2O3+ 2Cr
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната калия:
Cr2O3 + K2CO3 → 2KCrO2 + CO2
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом. Все соединения хрома (II) – сильные восстановители. 4CrO + O2→ 2Cr2O3
2. При высоких температурах оксид хрома (II) диспропорционирует:
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами.
Например, оксид хрома (II) взаимодействует с соляной кислотой:
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой: CrO + H2SO4 → CrSO4 + H2O
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Na2Cr2O7 + 2H2SO4 → 2CrO3 + 2NaHSO4 + H2O
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты: CrO3 + Н2O → Н2CrO4 2CrO3 + Н2O → Н2Cr2O7
2. Оксид хрома (VI) проявляет кислотные свойства. Взаимодействует с основаниями и основными оксидами.
Например, оксид хрома (VI) взаимодействует с гидроксидом калия с образованием хромата калия: CrO3+ 2KOH → K2CrO4+ H2O
Или с оксидом лития с образованием хромата лития:
CrO3 + Li2O → Li2CrO4
3. Оксид хрома (VI) – очень сильный окислитель: окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Например, сера окисляется до оксида серы (IV):
4CrO3 + 3S → 2Cr2O3 + 3SO2↑
Оксид хрома (VI) также окисляет сложные вещества, например, сульфиты: 2CrO3 + 3K2SO3 + 3H2SO4 → 3K2SO4 + Cr2(SO4)3 + 3H2O
И некоторые органические веществ, например, этанол:
4CrO3 + C2H5OH + 6H2SO4 → 2Cr2(SO4)2 + 2CO2 + 9H2O
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например, хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
CrCl3 + 3NH3 + 3H2O → Cr(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
K3[Cr(OH)6] + 3CO2 → Cr(OH)3↓ + 3KHCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например, хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
CrCl3 + 3KOH(недост) → Cr(OH)3↓ + 3KCl
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + CO2↑ + 6NaBr
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами. При этом образуются средние соли.
Например, гидроксид хрома (III) взаимодействует с соляной кислотой с образованием нитрата хрома (III):
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + 3HBr → CrBr3 + 3H2O
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
2Cr(OH)3 + 3SO3 → Cr2(SO4)3 + 3H2O
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли. При этом гидроксид хрома (III) проявляет кислотные свойства.
Например, гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
4. Гидроксид хрома (III) разлагается при нагревании:
2Cr(OH)3 → Cr2O3+ 3H2O
5. Под действием окислителей в щелочной среде переходит в хромат.
Например, при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
2Cr(OH)3+ 3Br2+ 10KOH → 2K2CrO4+ 6KBr + 8H2O
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
Например, хлорид хрома (II) реагирует с водным раствором аммиака с образованием гидроксида хрома (II) и хлорида аммония:
CrCl2 + 2NH3 + 2H2O → Cr(OH)2 + 2NH4Cl
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
Например, хлорид хрома (II) реагирует с гидроксидом калия с образованием гидроксида хрома (II) и хлорида калия:
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид хрома (II) проявляет основные свойства. В частности, реагирует с растворимыми кислотами.
Например, гидроксид хрома (II) взаимодействует с соляной кислотой с образованием хлорида хрома (II). Соли хрома (II) окрашивают раствор в синий цвет. Cr(OH)2 + 2HCl → CrCl2 + 2H2O
2. Гидроксид хрома (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид хрома (II) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (II): Cr(OH)2 + SO3 → CrSO4 + H2O
3. Гидроксид хрома (II) – сильный восстановитель.
Например, под действием кислорода воздуха гидроксид хрома (II) окисляется до гидроксида хрома (III): 4Cr(OН)2 + O2 + 2Н2О → 4Cr(OН)3
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например, хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
4CrCl2 + O2 + 20KOH + 2H2O → 4K3[Cr(OH)6] + 8KCl
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
CrCl2 + 4HNO3(конц)→ Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
2CrCl 2 + 4H 2 SO 4(конц) → Cr 2 (SO 4 ) 3 + SO 2 ↑ + 4HCl↑ +2H 2 O
Соли хрома (III)
Хром с валентностью III образует два типа солей:
· Соли, в которых хром (III) является катионом. Например, хлорид хрома (III) CrCl 3.
· Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III). Например, хромит калия, KCrO 2. или гексагидроксохромат (III) калия K 3 [Cr(OH) 6 ].
1. Соли хрома (III) проявляют слабые восстановительные свойства, окисляются под действием сильных окислителей в щелочной среде.
Например, бром в присутствии гидроксида калия окисляет хлорид хрома (III): 2CrCl3 + 3Br2+ 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Cr2(SO4)3+3Br2 + 16NaOH → 2Na2CrO4 + 6NaBr + 3Na2SO4+ 8H2O
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
2CrCl3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 6NaCl + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Cr2(SO4)3+6KMnO4 +16KOH → 2K2CrO4+ 6K2MnO4 +3K2SO4+ 8H2O
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например, гексагидроксохроматы окисляются бромом в щелочи:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH → 2Na2CrO4 + 6NaBr + 8H2O
2K3[Cr(OH)6] + 3Br2 + 4KOH → 2K2CrO4 + 6KBr + 8H2O
Оксид свинца (IV) также окисляет хромиты:
2KCrO2+ 3PbO2 + 8KOH → 2K2CrO4+ 3K2PbO2+ 4H2O
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
Cr(OH)3 + 3KOH → K3[Cr(OH)6]
3. Более активные металлы вытесняют хром (III) из солей.
Например, цинк реагирует с хлоридом хрома (III):
2CrCl3 + Zn → 2CrCl2 + ZnCl2
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr3+ + H2O = CrOH2+ + H+
II ступень: CrOH2+ + H2O = Cr(OH)2+ + H+
III ступень: Cr(OH)2+ + H2O = Cr(OH)3 + H+
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например, при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Cr2(SO4)3 + 6NaHSO3 → 2Cr(OH)3 + 6SO2 + 3Na2SO4
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + CO2↑ + 6NaBr
2Cr(NO3)3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 6NaNO3 + 3CO2↑
2CrCl3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 6NaCl + 3CO2↑
Cr2(SO4)3 + 3K2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами: Cr2O3+ Na2O → 2NaCrO2
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например, хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl(недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl(избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HNO3 → Cr(NO3)3 + NaNO3 + 2H2O
2NaCrO2 + 4H2SO4 → Cr2(SO4)3 +Na2SO4 + 4H2O
Под действием избытка воды хромиты гидролизуются:
NaCrO2 + 2H2O → Cr(OH)3↓ + NaОН
Соли хрома (VI)
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например, хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например, хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
2K2CrO4+ H2SO4(разб.) → K2Cr2O7+ K2SO4+ H2O
2K2CrO4+ 2HCl(разб.) → K2Cr2O7+ 2KCl + H2O
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например, дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия: K2Cr2O7 + 2KOH → 2K2CrO4+ H2O
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например, дихромат калия реагирует с сульфитом натрия в нейтральной среде:
K2Cr2O7 + 3Na2SO3 + 4H2O → 2Cr(OH)3↓ + 3Na2SO4 + 2KOH
Хромат калия окисляет сульфид аммония:
2K2CrO4 + 3(NH4)2S + 2H2O → 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например, хромат калия окисляет гидросульфид аммония в щелочной среде: 2K2CrO4 + 3NH4HS + 2H2O + 2KOH → 3S + 2K3[Cr(OH)6] + 3NH3
Хромат натрия окисляет сернистый газ:
2Na2CrO4 + 3SO2 + 2H2O + 8NaOH → 2Na3[Cr(OH)6] + 3Na2SO4
Хромат натрия окисляет сульфид натрия:
2Na2CrO4 + 3Na2S + 8H2O → 3S + 2Na3[Cr(OH)6] + 4NaOH
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например, дихромат калия окисляет сероводород в присутствии серной кислоты: 3H2S + K2Cr2O7 + 4H2SO4 → K2SO4+ Cr2(SO4)3 + 3S + 7H2O
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
K2Cr2O7+ 7H2SO4 + 6KI → Cr2(SO4)3 + 3I2 + 4K2SO4+ 7H2O
8K2Cr2O7 + 3Ca3P2+ 64HCl → 3Ca3(PO4)2 + 16CrCl3 +16KCl + 32H2O
K2Cr2O7+7H2SO4 + 6FeSO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7+ 4H2SO4 + 3KNO2 → Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
K2Cr2O7 + 3SO2 + 8HCl → 2KCl + 2CrCl3 + 3H2SO4 + H2O
K2Cr2O7 + 14HCl → 3Cl2 + 2CrCl3 + 7H2O + 2KCl