Расчеты рН в растворах сильных электролитов
Для характеристики кислотности среды обычно используют величину отрицательного десятичного логарифма молярной концентрации ионов Н+, которую называют водородным показателем рН:
рН = - lg С(Н+)
для нейтральной среды рН = 7,
для кислых растворов рН < 7,
для щелочных рН > 7.
Аналогичным образом реакция среды может быть охарактеризована гидроксильным показателем рОН:
рОН = - lg С(ОН-),
С(ОН-) – молярная концентрация ионов ОН-.
рН и рОН связаны между собой следующим образом:
рН + рОН = 14
Пример1: Рассчитать рН в 0,05М растворе серной кислоты.
Решение:
Для расчета рН необходимо узнать молярную концентрацию ионов (Н+). В растворах сильных электролитов концентрацию ионов можно узнать, записав уравнение диссоциации.
H2SO4 → 2H+ + SO42-
Это уравнение показывает, что при диссоциации 1 моль H2SO4 образуется 2 моль ионов H+ и 1 моль ионов SO42-. Таким образом, если известна молярная концентрация самой серной кислоты, то молярная концентрация ионов H+ будет в 2 раза больше.
С (H+) = 2∙ С(H2SO4) = 2 ∙ 0,05 моль/л = 0,1 моль/л
Находим рН:
pH = – lg C(H+) = – lg 0,1 = – lg 10-1 = 1
Таблица десятичных логарифмов чисел от 0 до 10
| число | |||||||||
| lg | 0,3 | 0,5 | 0,6 | 0,7 | 0,8 | 0,85 | 0,9 | 0,95 |
Пример 2. Рассчитать рН в 0,37% растворе гидроксида кальция (ρ = 1 г/мл).
Решение:
Записываем уравнение диссоциации электролита:
Ca(OH)2 → Ca2+ + 2OH-
В случае оснований нужно вначале найти молярную концентрацию ионов OH-, затем рОН, а потом рН.
В условии дана процентная концентрация раствора (ω %), ее необходимо перевести в молярную.
Перевод ω в С:
В этом случае нужно взять произвольную массу раствора, для удобства расчетов ее принимают за 100 г. Тогда в этой массе раствора содержится 0,37 г гидроксида кальция, или по формуле:
ω = 
m (Ca(OH)2) =  =
= 
Молярная концентрация это:
С= 
n(Ca(OH)2) = 
V раствора = 
С(Ca(OH)2) =  =
= 
С(ОН-) = 2 ∙ С(Ca(OH)2) = 2 ∙ 0,05моль/л = 0,1 моль/л (См. уравнение диссоциации)
Находим рОН, а затем рН.
pOH = – lg C(OH–) = – lg 0,1 = – lg 10-1 = 1
рН + рОН = 14, тогда
pH = 14 – pOH = 14 – 1 = 13
Пример 3. Какова молярная концентрация раствора соляной кислоты, рН которого равен 2? Чему равна ω этого раствора, если плотность 1 г/см3?
Решение:
Записываем уравнение электролитической диссоциации HCl:
HCl → H+ + Cl-
Зная рН раствора, можно найти молярную концентрацию ионов водорода по формуле:
С (Н+) = 10-рН
С (Н+) = 10-2 = 0,01 моль/л,
Из уравнения диссоциации следует, что концентрация HCl будет равна концентрации ионов H+, т.е. С (HCl) 0,01 моль/л (М).
Рассчитаем процентную концентрацию этого раствора.
Перевод С в ω:
В этом случае нужно взять произвольный объем раствора. Для удобства расчетов принимают объем равным 1 литру (1000 мл), тогда n = 0,01 моль, что следует из формулы:
С= 
Находим массу вещества и массу раствора:
m (в-ва) = n ∙ V = 0,01моль ∙ 36,5 г/моль=0,365 г
m (р-ра) = V∙ρ = 1000 мл∙1 г/мл=1000 г
ω =  =
= 
Расчет рН при разбавлении и смешивании растворов
Пример 4. 10 мл0,01М раствора соляной кислоты разбавили водой до 500 мл. Рассчитайте рН полученного раствора.
Дано:
С1(HCl)= 0,01моль/л
V1(HCl)= 10 мл
V2(HCl)= 500 мл
Решение:
Чтобы узнать рН, нужно рассчитать молярную концентрация полученного раствора, т.е. С2.
Следует учесть, что число моль соляной кислоты в процессе разбавления не меняется. Поэтому сколько моль HCl было до разбавления, т.е. в первом растворе, столько моль этой же кислоты окажется и во втором растворе:
n1 = n2,
или
С1V1 = C2V2
C2 =  = С1
= С1 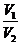
C2 = 
2-й вариант расчета C2:
 показывает во сколько раз разбавили раствор:
показывает во сколько раз разбавили раствор:  =
=  ,
,
значит в 50 раз уменьшилась концентрация полученного раствора по сравнению с исходной, т.е. С1.
C2 = 
Записываем уравнение электролитической диссоциации HCl:
HCl → H+ + Cl-
Из уравнения диссоциации следует, что С(H+) = С (HCl) = 0,0002 моль/л.
pH = – lg C(H+) = – lg 0,0002 = – lg 2∙10-4 = 4 – lg 2= 4 – 0,3 = 3,7
см. таблицу логарифмов
Для перевода концентраций можно использовать формулу:
C = 
ω = 
В этом случае нужно брать следующие единицы измерения используемых величин:
ω – в долях от единицы,
ρ – в г/л,
M – моль/л.
Пример 2:
0,37% раствор гидроксида кальция (ρ = 1 г/мл).
C = 
Пример 3.
С (HCl) 0,01 моль/л, ρ = 1 г/мл.
ω = 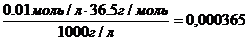 или 0,0365%
или 0,0365%