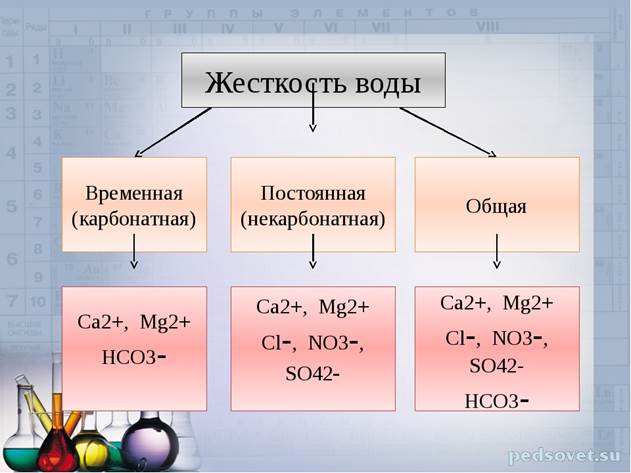
Жесткость воды Основные ее виды.
Методы определения жесткости и способы устранения.
Вода – главный реагент в химии. Именно свойства водных растворов определяют вид законов земной химии. Воды на Земле очень много. В составе атмосферы, гидросферы, литосферы и мантии её 1,6*1019 тонн.
В силу хорошей растворимости многих солей, и, прежде всего, солей s-металлов – большая часть земной воды является соленой. И только 0,6% жидкой воды гидросферы является доступной пресной водой. Однако «пресность» - ещё не гарантия достаточного качества воды.
Одним из наиболее важных показателей является жесткость воды.
Жесткость воды обусловливается наличием в ней ионов Са2+ и Mg2+. Для большинства производств жесткость воды является основным показателем её качества. Жесткость количественно выражается числом миллимолей (миллиграмм – эквивалентов) ионов кальция и магния в 1 л воды (ммоль/л; мг-экв/л; мэкв/л): 1мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са2+ или 12,15 мг/л ионов Mg2+.
Различают жёсткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка – «накипи»:
Са(НСО3)2 → СаСО3↓+Н2О+СО2↑;
2Mg(HCО3)2 → (MgOH)2CО3↓ +3СО2↑ +Н2О.
Таким образом, при кипячении карбонатная жесткость устраняется.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общая жёсткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием вводе растворенных солей кальция и магния и выражается количеством моль*эквивалентов в 1 л (ммоль /л, или мэкв/л, мг-экв/л).
Определение общей жесткости воды
Анализируемую воду подщелачивают аммонийной буферной смесью до рН ≈ 10. Индикатором служит обычно хромоген черный, образующий с ионами Са2+ и Mg2+ растворимые комплексы винно-красного цвета:
Са2+ + HInd2- → CaInd- + Н+;
винно-красный
Mg2+ + HInd2- → MgInd- + H+ .
винно-красный
Константы нестойкости этих комплексов равны соответственно 3,9∙10-6 и 1∙10-7. Смесь титруют раствором ЭДТА (комплексоном), при этом свободные ионы Ca2+ и Mg2+ связываются в более прочные бесцветные комплексы:
Сa2+ + [H2Y]2- → [CaY]2- + 2H+;
Mg2+ + [H2Y]2- → [MgY]2- + 2H+.
Константы нестойкости комплексов Са2+ и Mg2+ с ЭДТА гораздо меньше (2,7∙10-11 и 2∙10-9), поэтому при дальнейшем титровании в точке эквивалентности комплексы металлов c индикатором разрушаются и образуются более прочные комплексы с ЭДТА:
CaInd- + [H2Y]2- → [CaY]2-+ HInd- + H+
винно-красный синий
MgInd- + [H2Y]2- → [MgY]2- + HInd- + H+
винно-красный синий
В эквивалентной точке винно-красная окраска раствора сменяется синей вследствие накопления свободного индикатора (HInd).
По закону эквивалентов:
∑ n экв (Me2+) = n экв (ЭДТА) = NЭДТА∙ VЭДТА.
Следовательно общую жесткость воды можно вычислить по формуле
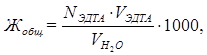
где VЭДТАи NЭДТА — соответственно объем и нормальная концентрация ЭДТА; VH2O - объем исследуемой воды.
Определение карбонатной жесткости
Временную (или карбонатную) жесткость определяют обычно методом нейтрализации, измеряя объём соляной (или серной) кислоты, пошедшей на титрование пробы воды в присутствии индикатора метилового оранжевого:
Са(НСО3)2 + 2HCl → СаСl2 + H2CО3;
HCO3- + H+ → H2O + CO2.
В соответствии с законом эквивалентов: NHCl∙VHCl = Nсоли·VH2O.
Отсюда 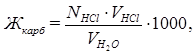 ,
,
где Nсоли, NHCl - нормальная концентрация соли и кислоты соответственно;
VHCl — объём раствора кислоты, пошедшей на титрование, мл;
Некарбонатную жесткость воды (Жнк ) рассчитывают по разности:
Жнк = Жобщ - Жкарб.
VH2O — объём пробы исследуемой воды, мл.
Способы устранения жесткости воды.
Для улучшения качества воды проводят специальные мероприятия для уменьшения ее жесткости (умягчение воды).
Временная жесткость устраняется посредством кипячения воды, поскольку при нагревании растворимые бикарбонаты переходят в плохо растворимые карбонаты и выпадают в осадок (накипь).
Методы обработки природных вод для технических целей.
1. Простейшим методом умягчения воды является ее кипячение. При этом гидрокарбонаты кальция переходят в плохорастворимые карбонаты и осаждаются: Ca(HCO3)2 → CaCO3 ↓ +CO2 ↑ +H2O Гидрокарбонаты магния образуют при кипячении карбонаты, которые более растворимы, чем гидроксиды. Поэтому в составе накипи появляются гидроксокарбонаты магния (Mg(OH))2CO3.
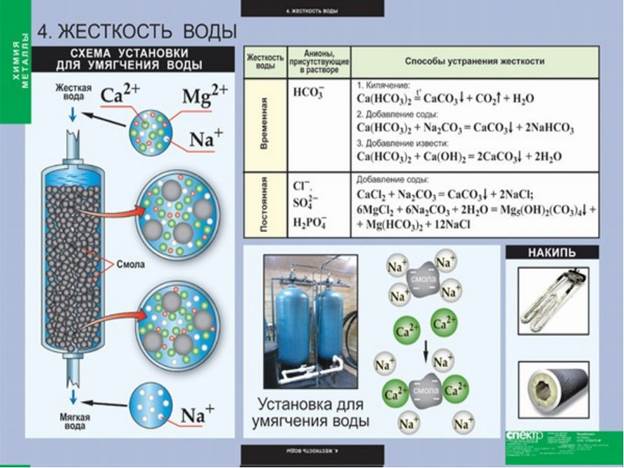
2. Химическая обработка воды (реагентный способ). В качестве химических реагентов для умягчения воды используются реагенты, которые в результате химического взаимодействия с растворенными солями кальция и магния дают плохо растворимые осадки. Такими реагентами являются гашеная известь Сa(OH)2, негашеная известь CaO, сода Na2CO3, фосфаты натрия (например, Na3PO4) и др. реагенты. Использование дешевой извести требует точного расчета для того, чтобы внести в воду такое количество Ca(OH)2, которое соответствует протеканию реакции перехода кислой соли в среднюю: Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 ↓ + 2H2O и не приведет к увеличению концентрации ионов Ca2+ при передозировке реагента.
3. Ионообменный метод. Наиболее совершенным способом умягчения воды является ее обработка с помощью ионообменных сорбентов («ионообменных смол», «ионитов»). Ионообменные сорбенты представляют собой гранулированные структуры, содержащие нерастворимый в воде молекулярный каркас (органический или неорганический полимер П), к которому химически «прикреплены» активные функциональные группы. Эти группы способны диссоциировать на ионы, один из которых остается связанным с каркасом, а другой переходит в раствор. Система находится в динамическом равновесии, а потому может «обменивать» первоначально имевшийся ион на другой, содержащийся в растворе. В случае, когда подвижным является катион (активная функциональная группа П–SO3 -H +), сорбент называется катионитом.
При пропускании жесткой воды через колонку, наполненную катионитом, происходит обмен содержащихся в ней ионов Ме+ (Na+, K +) и Ме2+ (Ca2+, Mg2+) на катионы водорода Н+. В уравнении присутствует специальный знак равенства ⇔.Это означает, что данная реакция может протекать как слева направо, так и справа налево. Такие реакции называются обратимыми. При очистке воды реакция в основном протекает слева направо, поскольку в исходном состоянии катионит насыщен катионами водорода. После достижения равновесия колонку отключают от потока и промывают небольшим количеством раствора кислоты. Равновесие смещается влево и катионит восстанавливается в своей активной форме. Важнейшей количественно характеристикой ионита является его адсорбционная (обменная) емкость. Эта величина равна количеству миллимоль-эквивалентов ионов, которые может связать 1 грамм ионита.
Основным недостатком этого способа является относительно высокая стоимость ионитов и необходимость специального оборудования (колонки, арматура, насосы).