Зиганшина С.Х., Хурсан С.Л., Назаров А.М., Калиниченко И.А.
Надежно установлено [1], что озонолиз ненасыщенных органических соединений протекает через стадию образования 1,2,3-триоксолана, который в дальнейшем распадается на карбонилоксид и кетон (или альдегид). 1,3-Циклоприсоединение карбонилоксида к связи C=O завершается образованием стабильного продукта озонолиза - 1,2,4-триоксолана. Таким образом, последняя реакция является важнейшей в механизме озонолиза олефинов, однако количественные данные о скорости этой реакции, а также о влиянии структуры реагентов на константу скорости практически отсутствуют. В настоящей работе методом импульсного фотолиза и кинетической спектрофотометрии измерены константы скорости реакции бензофеноноксида (БФО) с кетонами и дикетонами 1-14 в среде CH3CN и C6H6 при комнатной температуре.

БФО получали импульсным фотолизом растворов дифенилдиазометана, насыщенных кислородом воздуха [2]:
| Ph2CN2 1Ph2C: 3Ph2C:+O2 Ph2COO+Ph2CN2 Ph2COO+Ph2COO Ph2COO+RR’C=O | 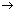


| 1Ph2C:+N2 3Ph2C: Ph2COO Ph2C=O+N2 2Ph2C=O=O2 1,2,4-триоксолан | (1) (ST, TS) (2) (3) (4) (5) |
Начальная концентрация Ph2CN2 во всех случаях составляла 1.8.10-4 моль/л. За расходованием БФО следили спектрофотометрически в растворе ацетонитрила на максимуме поглощения (410 нм), в бензоле - 415 нм [2].
Согласно схеме, убыль оптической плотности A, соответствующая расходованию БФО, описывается уравнением:

| (I) |
где коэффициент экстинкции  =1900 л/моль см [2], длина кюветы l=1 см, k4 - константа скорости реакции рекомбинации БФО. В ацетонитриле k4=1.8.17 лмоль·с, в бензоле k4=7.17 лмоль с [3].
=1900 л/моль см [2], длина кюветы l=1 см, k4 - константа скорости реакции рекомбинации БФО. В ацетонитриле k4=1.8.17 лмоль·с, в бензоле k4=7.17 лмоль с [3].
Методом нелинейного регрессионного анализа, используя известные значения А0 и k(2), находили константы k(1), линейно зависящие от концентрации RR’C=O. Из тангенса угла наклона этих зависимостей определяли абсолютные константы скорости взаимодействия БФО с кетонами k5 (табл.).
Таблица. Абсолютные константы скорости реакции БФО с карбонильными соединениями при 293 К.
| Соединение | [RR’CO], моль/л | Среда | k5, л/моль.с |
| Ph2CO (10) | 8.6.10-2  5.3 1-1
1.10-1 5.3 1-1
1.10-1  6 1-1 6 1-1
| CH3CN C6H6 | (0.8  0.2).103
(1.4 0.2).103
(1.4  0.9).103 0.9).103
|
| ц-C6H10O (3) | 1.10-3  9 1-2 9 1-2
| CH3CN | (2.03  0.41).103 0.41).103
|
| n-ClC6H4COCH3 (8) | 5.10-4  1.5 1-1 1.5 1-1
| C6H6 | (2  1).103 1).103
|
| PhCOCH3 (6) | 1.10-3  2.4 1-1
5.10-4 2.4 1-1
5.10-4  1.5 1-1 1.5 1-1
| CH3CN C6H6 | (2.5  0.2).103
(1.8 0.2).103
(1.8  0.8).103 0.8).103
|
| n-CH3C6H4COCH3 (7) | 1.10-3  2 1-1
1.10-3 2 1-1
1.10-3  1 1-1 1 1-1
| CH3CN C6H6 | (4.7  0.6).103
(6 0.6).103
(6  2).103 2).103
|
| камфара (4) | 5.10-4  3 1-2
5.10-4 3 1-2
5.10-4  3 1-2 3 1-2
| CH3CN C6H6 | (7  3).103
(12 3).103
(12  3).103 3).103
|
| адамантанон (5) | 1.10-3  1 1-2
1.10-3 1 1-2
1.10-3  1 1-2 1 1-2
| CH3CN C6H6 | (7.0  0.5).103
(30 0.5).103
(30  20).103 20).103
|
| CH3COC2H5 (1) | 5.10-3  1 1-1
5.10-3 1 1-1
5.10-3  1 1-1 1 1-1
| CH3CN C6H6 | (3.7  0.3).104
(6.7 0.3).104
(6.7  2.4).104 2.4).104
|
| втор-C4H9COPh (9) | 5.10-3  1 1-1 1 1-1
| CH3CN | (11  2).104 2).104
|
| ц-C5H8O (2) | 1.10-4  5 1-3 5 1-3
| C6H6 | (18  4).105 4).105
|
| C6H4O2 (12) | 5.10-4  1 1-2
2.5.10-4 1 1-2
2.5.10-4  1.5 1-1 1.5 1-1
| CH3CN C6H6 | (2.0  0.4).105
(19 0.4).105
(19  6).105 6).105
|
| CH3COCH2COCH3 (11) | 1.10-4  2 1-5 2 1-5
| CH3CN | (6  2).105 2).105
|
| димедон (13) | 3.10-4  1 1-2 1 1-2
| CH3CN | (11.2  1.5).105 1.5).105
|
| C8H5SF3O2 (14) | 5.10-6  3 1-5
5.10-8 3 1-5
5.10-8  5 1-6 5 1-6
| CH3CN C6H6 | (1900  700).105
(7000 700).105
(7000  1400).105 1400).105
|
Результаты исследования свидетельствуют, что кетоны характеризуются умеренной реакционной способностью: константа скорости их взаимодействия с БФО находится в интервале 103  105 л/моль.с. Повышенная реакционная способность наблюдается у циклопентанона 2, по-видимому, вследствие снятия в ходе реакции напряжения пятичленного цикла, создаваемого sp2-гибридизованным атомом углерода.
105 л/моль.с. Повышенная реакционная способность наблюдается у циклопентанона 2, по-видимому, вследствие снятия в ходе реакции напряжения пятичленного цикла, создаваемого sp2-гибридизованным атомом углерода.
Дикетоны характеризуются значительно более высокими константами скорости: ~105  108 л/моль.с. Аномально высокая реакционная способность дикетонов по отношению к БФО не укладывается в общие представления о механизме реакции карбонилоксидов с карбонильной группой. По-видимому, для дикетонов, имеющих подвижную С-Н связь, реализуется иной механизм взаимодействия. По нашим данным, константа скорости гибели БФО в присутствии карбоновых кислот резко возрастает: эффективная константа скорости первого порядка лежит в интервале 108
108 л/моль.с. Аномально высокая реакционная способность дикетонов по отношению к БФО не укладывается в общие представления о механизме реакции карбонилоксидов с карбонильной группой. По-видимому, для дикетонов, имеющих подвижную С-Н связь, реализуется иной механизм взаимодействия. По нашим данным, константа скорости гибели БФО в присутствии карбоновых кислот резко возрастает: эффективная константа скорости первого порядка лежит в интервале 108  109 л/моль.с. Дикетоны, являющиеся сильными С-Н кислотами, могут реагировать с БФО по аналогичному механизму. По-видимому, первой стадией этого механизма является электрофильная атака карбонилоксидом атома углерода, находящегося между карбонильными группами. Действительно, наблюдается прямая пропорциональность между кислотностью дикетонов и константой скорости реакции БФО с дикетонами. Чем выше кислотность органического субстрата, тем больше степень закомплексованности БФО и тем возможно больше константа скорости комплексообразования, что и приводит к увеличению константы скорости гибели БФО по первому порядку.
109 л/моль.с. Дикетоны, являющиеся сильными С-Н кислотами, могут реагировать с БФО по аналогичному механизму. По-видимому, первой стадией этого механизма является электрофильная атака карбонилоксидом атома углерода, находящегося между карбонильными группами. Действительно, наблюдается прямая пропорциональность между кислотностью дикетонов и константой скорости реакции БФО с дикетонами. Чем выше кислотность органического субстрата, тем больше степень закомплексованности БФО и тем возможно больше константа скорости комплексообразования, что и приводит к увеличению константы скорости гибели БФО по первому порядку.
Список литературы
Bailey P.S. Ozonization in organic chemistry. V. 1. N.Y.: Acad. Press, 1978. 272 p.
Назаров А.М., Чайникова Е.М., Хурсан С.Л. и др. // Известия РАН. Сер. хим. 1998. № 7. С. 1329-1332.
Nazarov A.M., Chainikova E.M., Khursan S.L. et al. // React. Kinet. Catal. Lett. 1998. V. 65. № 2. P. 311-314.