Присутствие в среде роста микроорганизмов быстро усваиваемого углевода может репрессировать синтез ферментов, вовлеченных в метаболизм других содержащих углерод соединений. Наиболее эффективным источником углерода, вызывающим такую репрессию, служит глюкоза. В связи с этим возникли понятия «эффекта глюкозы» и «катаболитной репрессии» (20). Установлено, что, помимо ферментов углеродного метаболизма, катаболитной репрессии подвержены еще многие белки клетки, вовлеченные в такие процессы, как биолюминесценция, фотосинтез, споруляция, биосинтез пигментов и антибиотиков, а также внеклеточная деградация макромолекул (21).
В 1965 году Макмэн и Сазерленд открыли существование у E. coli циклического производного АМФ (3’,5’-цикло-AMP, или цАМФ) и показали, что его внутриклеточная концентрация варьирует инверсивно по отношению к скорости роста клеток при варьировании источника углерода (22). Последующая идентификация белка-рецептора цАМФ (CRP) и описание фенотипических характеристик штаммов с нарушениями либо фермента биосинтеза цАМФ, аденилатциклазы (ген cya), либо белка CRP (ген crp) привели к пониманию, что явление катаболитной репрессии связано с отсутствием в клетке цАМФ или CRP (23, 24). Мутанты с поврежденными генами cya или crp не способны усваивать большинство источников углерода (лактозу, мальтозу, глицерин и т. д.), поскольку у них не индуцируется синтез необходимых ферментов. Вместе с тем, все гены, которые не могут экспрессироваться в cya - и crp -мутантах, являются мишенями катаболитной репрессии. На основании этих данных была сформулирована концепция позитивной регуляции углеродного метаболизма на генетическом уровне: экспрессия генов, подверженных катаболитной репрессии, прямо пропорциональна внутриклеточной концентрации цАМФ, действие которого осуществляется через белок CRP, являющийся активатором инициации транскрипции (20; рис. 2). Соответственно своей регуляторной функции белок CRP получил второе, широко используемое обозначение – CAP, или белок-активатор генов катаболизма (C atabolite gene A ctivator P rotein).
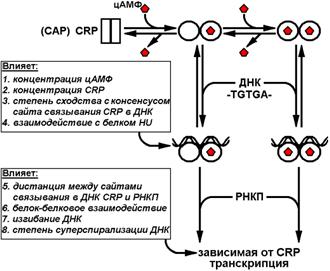
Рис. 2. Обобщенная схема позитивной регуляции CRP- (или CAP-) зависимых промоторов в клетках E. coli (20, 23). Сдвоенные прямоугольники обозначают свободный димер белка CRP, сдвоенные окружности – димер CRP, у которого изменена конформация в результате формирования комплекса с одной или двумя молекулами цАМФ. TGTGA – консенсус последовательности нуклеотидов в ДНК (двойная витая линия), с которыми связывается белок CRP в комплексе с цАМФ (детали в тексте).
Молекулярные механизмы активирующего действия комплекса цАМФ-CRP на инициацию транскрипции хорошо изучены (23, 24, 25) и в основных чертах схожи с механизмами действия других позитивных регуляторов транскрипции (26). Анализ трехмерной структуры белка CRP выявил определенные изменения его конформации в комплексе с цАМФ (24). Таким образом, когда концентрация цАМФ высока, этот циклический нуклеозид ассоциируется с белком CRP, который уже в «лигандной форме» способен связываться со специфическими участками ДНК в промоторных областях генов, представляющих так называемый цАМФ-CRP-модулон (20). Белок CRP изгибает дуплекс ДНК и участвует в кооперативном связывании РНКП (27), взаимодействуя с ее a-субъединицей (28). Изгибание ДНК является важным фактором регуляции, способствующим ассоциации белка CRP с РНКП и последующему формированию открытого комплекса РНКП-промотор (см. ниже). Известно, что изгиб ДНК происходит в центре сайта связывания CRP, при этом угол изгиба составляет от 90 до 1300 в зависимости от состава нуклеотидов сайта связывания (23).
К наиболее важным факторам, детерминирующим способность белка CRP активировать транскрипцию, относятся: степень сходства конкретного сайта связывания CRP в ДНК с сайтом-консенсусом, длина спейсера между двумя половинами палиндрома сайта связывания, локализация сайта связывания относительно функциональных элементов промотора и наличие кооперативных или антагонистических белок-белковых взаимодействий с участием CRP (20). Консенсус узнаваемых белком CRP последовательностей является 22-членным палиндромом – AA A TGTGA TC TA GA TCACA T TT (подчеркнуты наиболее консервативные нуклеотиды). Например, сродство лигандной формы CRP в 450 раз выше к консенсусной последовательности, чем к сайту связывания CRP рядом с промоторной областью lac -оперона (29). Две половины палиндрома, содержащие участок TGTGA, где осуществляется основной контакт с белком, может разделять спейсер длиной не 6, а 8 пн. У таких сайтов участки TGTGA несколько развернуты относительно друг друга в двойной спирали ДНК. В результате меняется стехиометрия, и, соответственно, сила (снижается) взаимодействия с ДНК двух симметричных ДНК-связывающих доменов в димере CRP (30). Значение локализации сайта связывания белка CRP относительно функциональных элементов промотора было детально исследовано на примере регуляции lac -оперона (31). Искусственно сконструированные производные lac -промотора, различающиеся положением CRP-сайта на участке 51.5–96.5 пн от точки старта транскрипции, проявляли активность только в присутствии комплекса цАМФ-CRP и при условии, что CRP-сайт и участки связывания РНКП были разделены целым числом витков спирали и, соответственно, располагались в одной проекции на дуплекс ДНК. Вместе с тем, сила таких промоторов убывала по мере удаления CRP-сайта от точки старта транскрипции. Известно также, что на функцию белка CRP положительно влияют суперспирализация ДНК и его взаимодействие с превалирующим ДНК-связывающим белком клетки, HU (32).
В основе регуляторной связи между наличием (или отсутствием) глюкозы и экспрессией генов катаболизма сахаров лежит функционирование фосфоенолпируват-зависимой фосфотрансферазной системы (PTS), координирующей уровни содержания в клетке цАМФ и индукторов цАМФ-активируемых оперонов (33). Роль главного эффектора катаболитной репрессии принадлежит белку IIAglc (рис. 3), продукту гена crr (catabolite repression regulator), последнему члену в цепи PTS-белков, осуществляющих двунаправленный перенос друг через друга фосфатной группы, первичным донором
которой служит фосфоенолпируват.
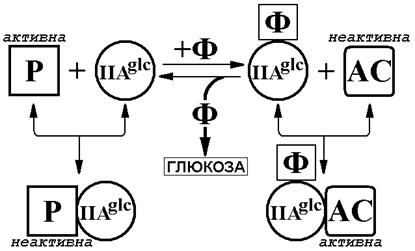
Рис. 3. Схема модуляции активности аденилатциклазы (AC) и пермеаз (P) сахаров не PTS-класса с помощью белка-эффектора катаболитной репрессии IIAglc в фосфорилированном (+фосфат, Ф) или дефосфорилированном (в присутствии глюкозы) состоянии (20, 34). Дефосфорилирование белка IIAglc-Ф при наличии в среде глюкозы приводит к координированной деактивации аденилатциклазы (транзитная репрессия), а также пермеаз и некоторых других ферментов, генерирующих индукторы оперонов, вовлеченных в контроль метаболизма альтернативных глюкозе источников углерода (исключение индуктора). Одновременное снижение в клетке и концентрации цАМФ, и концентрации индукторов является средством двойной регуляции транскрипции генов, подверженных катаболитной репрессии (детали в тексте).
Глюкоза выступает в качестве конкурентного акцептора фосфатной группы в реакции, катализируемой одним из компонентов PTS – пермеазой глюкозы. Отдавая свой фосфат транспортируемой в клетку глюкозе, PTS-пермеаза инициирует обратный перенос фосфата в PTS, что приводит к дефосфорилированию белка IIAglc (34). В зависимости от своего статуса белок-эффектор катаболитной репрессии проявляет разные функции: в фосфорилированной форме (IIAglc-Ф) он аллостерически активирует аденилатциклазу (повышается синтез цАМФ), а в дефосфорилированной – аллостерически ингибирует пермеазы сахаров, таких как лактоза (сахара не PTS-класса), и некоторые другие ферменты катаболизма, в частности, глицеролкиназу (21). Таким образом, присутствие глюкозы обусловливает дефосфорилирование белка IIAglc-Ф, что одновременно приводит и к инактивации аденилатциклазы (транзитная репрессия), и к ингибированию активности пермеаз или других белков, генерирующих в клетке индукторы оперонов катаболизма сахаров не PTS-класса (исключение индуктора) (рис. 3).
С явлением катаболитной репрессии связаны еще три регуляторных механизма (20). Один из них заключается в том, что глюкоза не только ингибирует синтез цАМФ, но стимулирует также активное удаление цАМФ из цитоплазмы (22). В таком понижении внутриклеточной концентрации цАМФ участвует система транспорта циклических нуклеотидов, зависящая от мембранного потенциала, генерируемого только в максимально богатых энергией клетках (35). Другой механизм основан на том, что промотор гена cya, кодирующего аденилатциклазу, подвержен частичной репрессии белком CRP в комплексе с цАМФ (2-4-кратное снижение транскрипционной активности гена cya). Таким образом, в присутствии глюкозы экспрессия гена cya достигает максимально высокого уровня. Данный эффект глюкозы, заключающийся в дерепрессии синтеза аденилатциклазы, противоположен по знаку эффекту «транзитной репрессии», который проявляется в снижении внутриклеточной концентрации цАМФ. Значение активирующего действия глюкозы на экспрессию гена cya очевидно – это повышение потенциала синтеза цАМФ и, следовательно, повышение способности клетки быстро адаптироваться к другому источнику углерода при истощении запаса глюкозы. Третий механизм дополнительной настройки экспрессии генов, подверженных катаболитной репрессии, базируется на авторегуляции гена crp. В зависимости от концентрации глюкозы белок CRP в комплексе с цАМФ либо репрессирует (много глюкозы, мало цАМФ), либо активирует (мало глюкозы, много цАМФ) транскрипцию собственного гена. Наличие у комплекса CRP-цАМФ двух диаметрально противоположных авторегуляторных функций, по-видимому, связано с возможностью частичного (наполовину) или полного аденилирования димера CRP (36; рис. 2). Таким образом, в ответ на присутствие глюкозы, кроме снижения концентрации цАМФ, происходит авторегуляторное подавление синтеза белка CRP, что служит дополнительным механизмом усиления катаболитной репрессии. При устранении глюкозы для восстановления высокой активности (транскрипция и трансляция) гена crp требуется значительно больше времени, чем для синтеза цАМФ, поэтому механизм контроля катаболитной репрессии, основанный на авторегуляции гена crp, условно назван «перманентной репрессией» (20).