Определение, строение молекулы, номенклатура.
Фенолы – производные ароматических углеводородов, в состав которых могут входить одна или несколько гидроксильных групп, соединенных с бензольным кольцом.
По правилам ИЮПАК сохраняется название «фенол ». Нумерация атомов идет от атома, который непосредственно связан с гидрокси-группой (если она – старшая) и нумеруют так, чтобы заместители получили наименьший номер.
Представитель – фенол – С6Н5ОН:

Строение фенола.
У атома кислорода на внешнем уровне находится неподеленная электронная пара, которая «втягивается» в систему кольца (+М-эффект ОН -группы). В результате могут возникнуть 2 эффекта:
1) повышение электронной плотности бензольного кольца в положения орто- и пара-. В основном, такой эффект проявляется в реакциях электрофильного замещения.
2) уменьшается плотность на атоме кислорода, вследствие чего связь О-Н ослабляется и может рваться. Эффект связан с повышенной кислотности фенола по сравнению с предельными спиртами.
Монозамещенные производные фенола (крезол) могут быть в 3х структурных изомерах:

Свойства фенолов.
Физические свойства фенолов.
Фенолы – кристаллические вещества при комнатой температуре. Плохо растворимы в холодной воде, но хорошо – в горячей (уже при 70ºС растворяется в любых отношениях) и в водных растворах щелочей. Обладают характерным запахом. Вследствие образования водородных связей, обладают высокой температурой кипения и плавления − его t плавления = 40,9ºС. Фенол ядовит.
Химические свойства фенола.
В фенолах p-орбиталь атома кислорода образует с ароматическим кольцом единую систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как с щелочными металлами:
2С6Н5ОН + 2Na → 2C6H5ONa + H2↑,
фенолят натрия
так и с их гидроксидами (отсюда старинное название "карболовая кислота"):
С6Н5ОН + NaOH → C6H5ONa + Н2О.
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая:
C6H5ONa + СО2 + Н2О → С6Н5ОН + NaHCO3.
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
С6Н5ОН + СН3―CO―Cl → С6Н5―О―СО―СН3 + HCl.
3. Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах. Поскольку ОН группа является ориентантом I рода, то в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях (при галогенировании, нитровании, поликонденсации и т.д.). Так, при действии бромной воды на фенол три атома водорода замещаются на бром, и образуется осадок 2,4,6-трибромфенола:
 (2)
(2)
Это — качественная реакция на фенол.
При нитровании фенола концентрированной азотной кислотой три атома водорода замещаются на нитрогруппу, и образуется 2,4,6-тринитрофенол (пикриновая кислота):

При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации, и образуется фенолформальдегидная смола − высокомолекулярное соединение с разветвленной структурой типа:
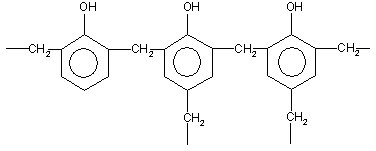
4. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
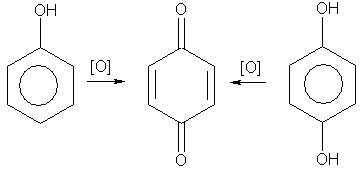 (3)
(3)
5. Качественная реакция на фенол − реакция с раствором FeCl3 с образованием комплексного иона фиолетового цвета:
3C6H5OH +FeCl3 → (C6H5O)3Fe +3HCl (фиолетовое окрашивание)
Наряду с реакцией (2), это — качественная реакция на обнаружение фенола.